病毒间也上演“宫斗剧”?Nature:科学家揭示噬菌体如何通过超级感染排除机制保护后代
来源:生物谷原创 2025-07-22 09:35
来自多伦多大学等机构的科学家们通过研究揭示了噬菌体如何通过一种独特的机制保护其后代免受同类竞争,从而在微生物群体中更有效地传播。
在微生物世界中,病毒与宿主的博弈从未停歇。近年来,随着微生物学研究的深入,噬菌体与宿主细菌的相互作用成为热门领域。地球上噬菌体的数量可能超过所有其他生物体的总和,它们在生态系统中扮演关键角色,包括调节细菌种群、促进基因水平转移等。然而,噬菌体间的竞争同样激烈,它们进化出多种机制抑制其他病毒对同一宿主细胞的感染,这种现象被称为 “超级感染排除”。
近日,发表于《自然》(Nature)杂志的研究“Prophages block cell surface receptors to preserve their viral progeny”,由多伦多大学等机构的科学家完成。该研究揭示了噬菌体通过独特机制保护后代免受同类竞争、在微生物群体中高效传播的过程,为理解病毒与宿主的复杂相互作用提供了新视角,也为开发新型抗菌策略奠定了理论基础。

噬菌体的“反克洛诺斯效应”
噬菌体的 “超级感染排除” 机制早已被发现,但其进化意义和具体机制仍不明确。本研究聚焦于铜绿假单胞菌(Pseudomonas aeruginosa)的噬菌体 JBD26,发现其编码的一种名为 Zip 的蛋白能通过调节宿主细胞表面受体,既实现超级感染排除,又保护自身后代不被 “误吞”,这种机制被命名为 “反克洛诺斯效应”(anti-Kronos effect)—— 得名于希腊神话中吞噬亲子的泰坦神克洛诺斯,寓意噬菌体通过该机制避免后代被宿主细胞 “吞噬”。
实验解析:Zip 蛋白如何调控宿主受体?
研究通过多种技术手段(细菌双杂交、蛋白质共纯化、荧光显微镜、基因敲除等),系统探究了 Zip 的作用机制:
1. Zip 与宿主菌毛的 “精准互动”
铜绿假单胞菌的 IV 型菌毛是多种噬菌体的感染受体,同时参与细菌的运动、黏附和生物膜形成。研究发现,Zip 蛋白通过与菌毛组装的关键伴侣分子 PilZ 结合,形成 “Zip-PilZ-PilB” 三元复合物(PilB 是菌毛延伸的 ATP 酶)。这种结合不会完全阻断菌毛功能,而是 “精细调节” 其动态:在低细胞密度时缩短菌毛长度(从野生型的 0.6μm 缩短至 0.4μm),在高细胞密度时减少约 60% 细胞的菌毛数量。这种调节既避免了细菌因失去菌毛导致的 fitness 损失(如无法黏附或形成生物膜),又能阻止依赖菌毛的噬菌体感染。
2. 群体感应的 “智能调控”
噬菌体 JBD26 的 Zip 蛋白表达受宿主群体感应系统(QS)调控。研究发现,Zip 的启动子区域存在 LasR(群体感应核心调控因子)的结合位点,当细胞密度升高时,LasR 激活 Zip 表达,增强对菌毛的调控;而在低细胞密度时,Zip 表达降低,减少对细菌正常生理活动的干扰。这种动态调控使噬菌体既能在高密度环境中抵御同类竞争,又能在低密度环境中保留基因交流的可能,平衡了即时保护与长期进化潜力。
3. 保护后代的 “反克洛诺斯效应”
关键实验显示,当 JBD26 噬菌体的zip基因被敲除后,其自发诱导产生的后代噬菌体在 20 小时内滴度从约 10⁵ PFU/ml 骤降至 500 PFU/ml,而野生型则能积累至 10⁶ PFU/ml。这是因为缺失 Zip 时,新释放的噬菌体容易再次感染含相同原噬菌体的宿主细胞( lysogen),导致 “无效感染” 和后代损失;而 Zip 通过调节菌毛,阻止了这种 “自相残杀”,使游离噬菌体在群体中大量积累,更易感染未被侵染的细菌。
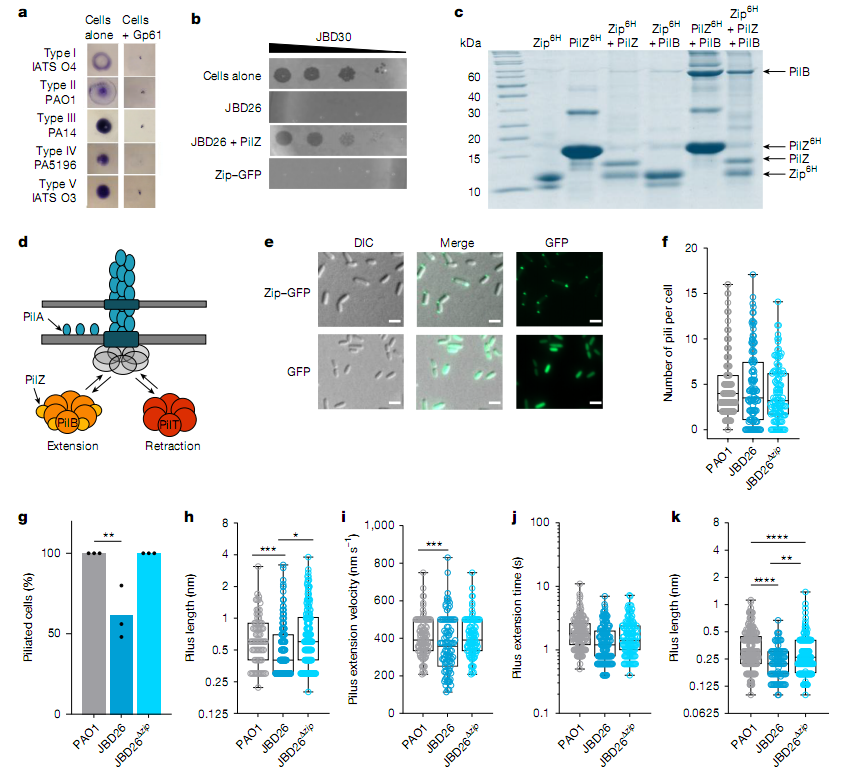
Zip能靶向作用保守的菌毛伴侣分子PilZ
跨物种的 “生存智慧”
研究进一步发现,“反克洛诺斯效应” 并非 JBD26 独有,而是在多种噬菌体中广泛保守,且机制多样:
铜绿假单胞菌噬菌体 LESϕ3:通过编码 Gp50 蛋白阻断菌毛功能,缺失该基因后,噬菌体后代滴度下降 10⁴倍;
铜绿假单胞菌噬菌体 JBD44:通过修饰宿主脂多糖(LPS)受体(而非菌毛),避免后代被同类感染,缺失相关基因后,噬菌体滴度下降 10⁴倍;
沙门氏菌噬菌体 ε15和大肠杆菌噬菌体 HK97:分别通过改变 O 抗原结构、阻断 DNA 注入通道实现类似效应,缺失关键基因后,后代滴度下降 100-1000 倍。
这些结果表明,无论通过调控菌毛、LPS 还是其他受体,噬菌体均进化出保护后代的策略,且这些 “反克洛诺斯基因” 多与噬菌体的结构基因(如尾管、尾刺)相邻,确保重组噬菌体仍能保留自我保护能力。
小结
综上,本文研究结果不仅揭示了噬菌体在微生物群体中传播的新机制,还为理解病毒与宿主之间的复杂相互作用提供了新的视角。研究者表示,超级感染排除机制在噬菌体中普遍存在,而这一发现表明噬菌体或能通过调节宿主细胞表面受体的动态来保护其后代免受同类竞争,这种机制不仅有助于噬菌体在微生物群体中更有效地传播,还为开发新型抗菌策略提供了理论基础。
此外,研究者还发现,噬菌体能通过利用宿主的群体感应系统(QS系统,Quorum sensing)来调节Zip蛋白的表达从而实现对超级感染排除的动态调控,这种调控机制使得噬菌体能在不同环境下灵活调整其防御策略,既能在高密度环境中有效保护自身后代,又能在低密度环境中允许基因交流从而增加进化潜力。(生物谷Bioon.com)
参考文献:
Taylor, V.L., Patel, P.H., Shah, M. et al. Prophages block cell surface receptors to preserve their viral progeny. Nature (2025). doi:10.1038/s41586-025-09260-z
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


