《先进科学》:山东大学团队发现促进α-Syn蛋白降解的新机制,为帕金森病带来治疗新靶点!
来源:奇点糕 2025-01-25 10:19
该研究揭示了,OTUD5主要通过促进α-Syn的K63连接的多泛素化,来调节α-Syn的降解,进而发挥保护多巴胺能神经元的作用。
近期,山东大学刘慧青、高成江团队发表了一项重要研究成果。他们揭示了卵巢肿瘤蛋白酶去泛素化酶5(OTUD5)调控α-Syn降解的机制,为PD的治疗提供了新的方向。
具体来说,研究发现,OTUD5可以通过反向调节α-Syn水平,保护多巴胺能神经元免受损伤。机制上,OTUD5调节α-Syn水平并不依赖于自身的去泛素化酶活性,而是作为适配蛋白,通过招募E3泛素连接酶NEDD4,来促进α-Syn的K63连接的多泛素化,并通过内体溶酶体途径实现对α-Syn的降解。
研究发表在Advanced Science上。

既往研究显示,α-Syn降解方式多与泛素化有关。泛素化是一个可逆过程,受到E3泛素连接酶和去泛素化酶的调控。其中多项研究已经证实,E3泛素连接酶NEDD4可促进α-Syn的K63连接的多泛素化,从而通过内体溶酶体途径对α-Syn进行降解。但是关于去泛素化酶是否能调控α-Syn降解,以及其背后的分子机制还不清楚。
OTUD5作为一种去泛素化酶,不仅可以在包括大脑在内的多种器官中表达,还有增强抗病毒感染和抗肿瘤免疫的功能。更重要的是,有研究显示,PD患者存在OTUD5表达降低的现象,因此,研究人员猜测,OTUD5或许能通过调控α-Syn降解,来影响PD病理进程。
为了验证这一猜想,研究人员进行了体外功能试验,结果发现,过表达OTUD5可以减少SH-SY5Y细胞(PD细胞模型)中α-Syn的蛋白水平,相反,敲低OTUD5则显著增加了SH-SY5Y细胞中α-Syn的蛋白水平。这提示,OTUD5可以反向调节α-Syn蛋白水平。而进一步的实验发现,OTUD5反向调节α-Syn蛋白水平是通过加速α-Syn降解途径来实现的。
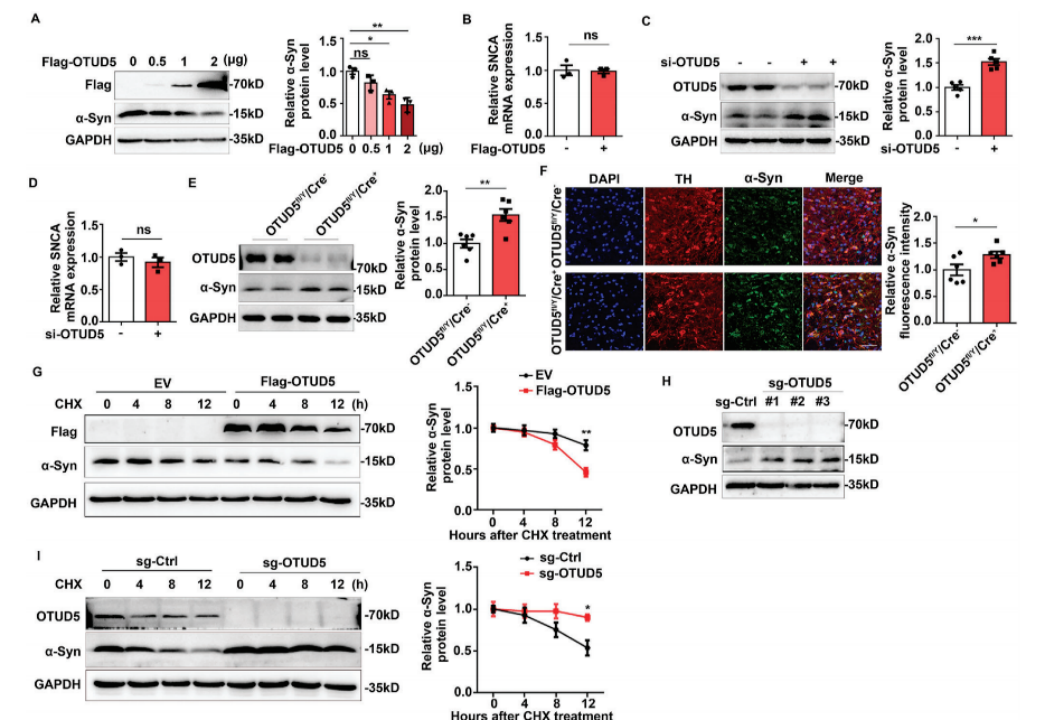
OTUD5加速α-Syn降解
鉴于泛素-蛋白酶体途径和溶酶体途径是调节α-Syn降解的两大途径。利用选择抑制剂,即使用MG132来抑制蛋白酶体功能,使用氯喹抑制内体溶酶体功能,使用3-甲基腺嘌呤抑制自噬后,研究人员发现,OTUD5调控α-Syn的降解过程只有在使用氯喹时被阻断,这表明OTUD5促进α-Syn降解主要是通过内体溶酶体途径。
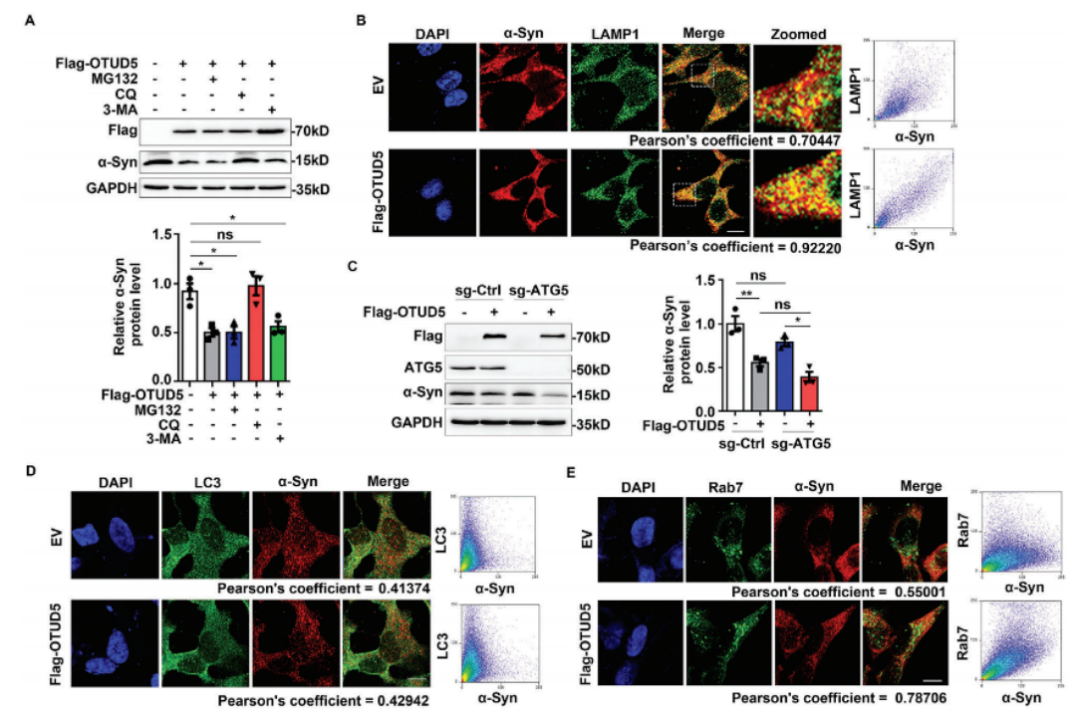
OTUD5促进α-Syn降解主要是通过内体溶酶体途径
随后通过将编码OTUD5和酶活性突变体OTUD5的质粒转染到SH-SY5Y细胞中,研究人员发现,无论是过表达OTUD5还是OTUD5突变体,都可以显著降低α-Syn的蛋白水平。这说明,OTUD5虽然是一种去泛素化酶,但其调控α-Syn的降解过程与自身酶活性无关。更重要的是,接下来的体内外实验均证实,过表达OTUD5显著增加了α-Syn的多泛素化。
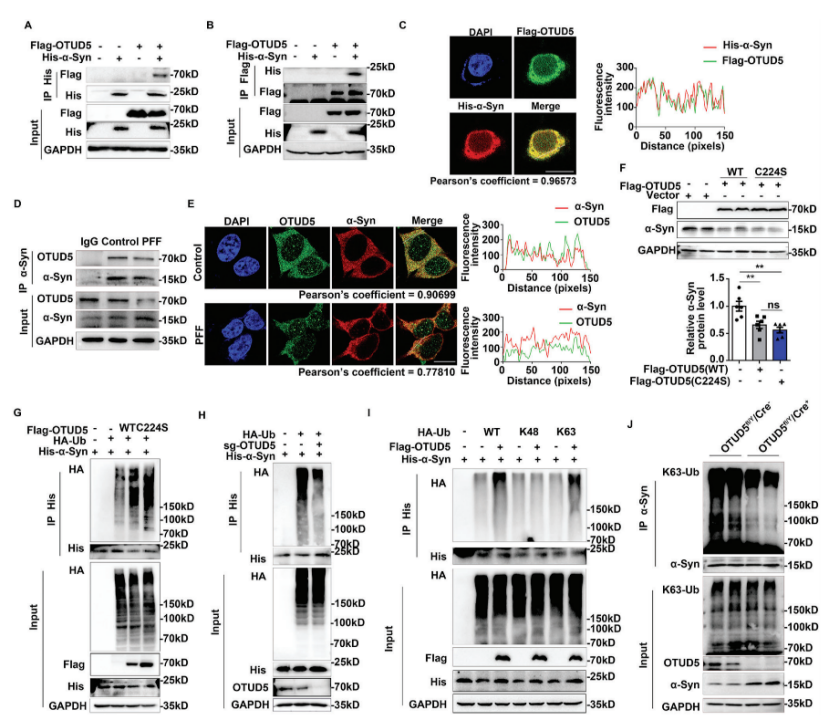
过表达OTUD5显著增加了α-Syn的多泛素化
进一步,机制上,研究人员发现,OTUD5可作为适配蛋白,可通过招募E3泛素连接酶NEDD4,并与其结合,来促进α-Syn的K63连接的多泛素化,并最终通过内体溶酶体途径实现对α-Syn的降解。
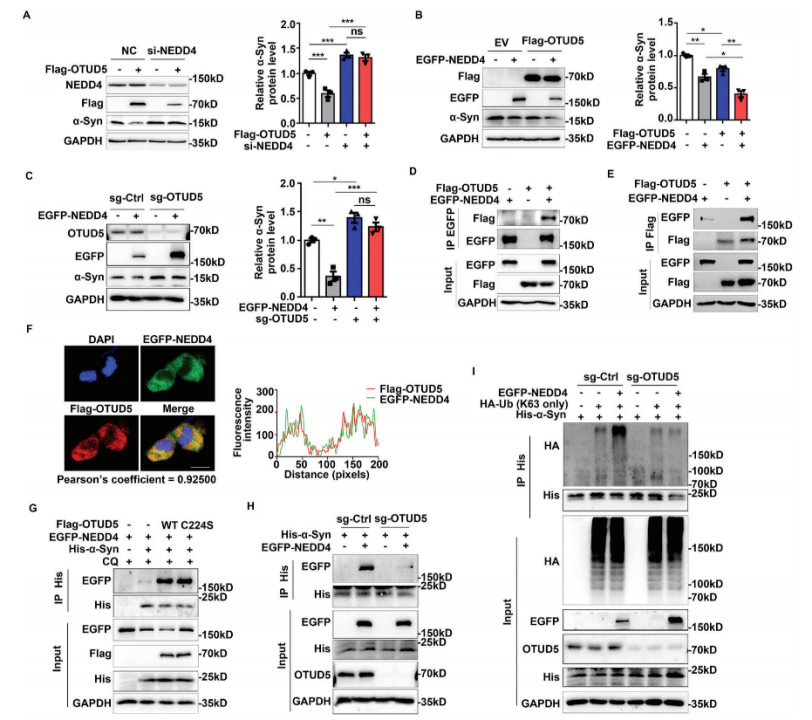
机制结果
最后,研究还建立了OTUD5敲除PD小鼠模型,并探究了OTUD5对小鼠多巴胺能神经元的影响。
结果发现,在多巴胺能神经元中特异性敲除OTUD5,会进一步增加病理性聚集α-Syn的水平,加剧α-Syn病理引发的多巴胺能神经元退行性病变(小鼠运动障碍明显,多巴胺能神经元丧失明显)。这也意味着,OTUD5可通过减少α-Syn的积累,起到保护多巴胺能神经元的作用。
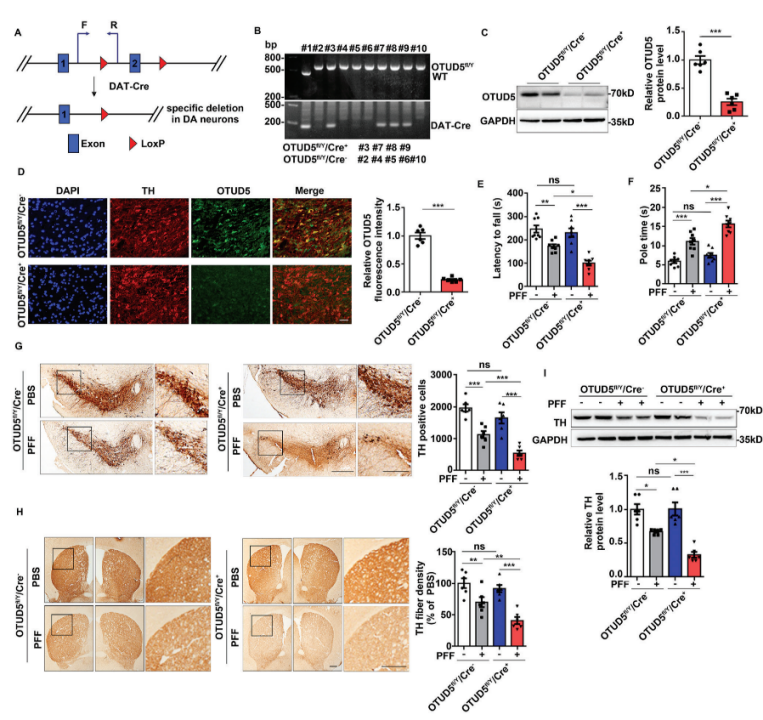
敲除OTUD5加剧小鼠退行性病变
总之,该研究揭示了,OTUD5主要通过促进α-Syn的K63连接的多泛素化,来调节α-Syn的降解,进而发挥保护多巴胺能神经元的作用。该研究结果不仅证实了OTUD5有成为PD等神经退行性疾病治疗靶点的潜力,也为PD的治疗提供了新的方向。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


