Nat Commun | 张敏/邓春华/施雪涛发现维持睾丸免疫微环境稳态的新机制
来源:生物探索 2024-03-12 09:09
该研究首次揭示了线粒体转移是SLCs维持睾丸免疫微环境稳态的强大机制,这是一个新的治疗靶点,以限制与男性不育相关的免疫相关疾病的炎症。
中山大学张敏、邓春华及华南理工大学施雪涛共同通讯在Nature Communications 发表题为“Stem Leydig cells support macrophage immunological homeostasis through mitochondrial transfer in mice”的研究论文,该研究观察到SLCs移植恢复了缺血再灌注损伤小鼠模型的雄性生育力和睾酮生成。SLCs通过线粒体转移到巨噬细胞来阻止炎症级联反应。
活化的巨噬细胞释放的活性氧(ROS)通过瞬时受体电位阳离子通道亚家族成员7 (TRPM7)介导的方式诱导线粒体从SLCs转移到巨噬细胞。值得注意的是,在移植的 SLC 中敲除 TRPM7 会损害睾丸缺血再灌注和睾丸衰老小鼠模型的治疗结果。这些发现揭示了SLCs移植的新机制,可能有助于保护免疫相关性腺功能减退症男性患者的睾丸功能的新机制。

睾丸功能依赖于稳态的间质微环境,这对于持续的精子发生至关重要。组织驻留间充质基质细胞是损伤的传感器,积极与组织微环境进行通信。间质干细胞(SLC)是驻留在睾丸间质中的组织特异性多能基质细胞。然而,只有少数自体SLC可以分化为LC,并且在衰老的非人灵长类动物模型中,移植后仅4-8周血清睾酮水平的增加以低度炎症反应为特征。人们普遍认为,间充质基质细胞的修复功能依赖于它们与许多组织中免疫微环境的相互作用。然而,SLCs是否对局部微环境具有广泛的免疫调节特性尚未得到研究。
睾丸驻留TCF21+间充质基质细胞类似于SLC,可在损伤或衰老时被激活以支持 LC 再生。值得注意的是,TCF21+间充质基质细胞和巨噬细胞之间发生了细胞间对话。虽然其机制尚未完全阐明,但这些证据表明SLCs可能是潜在的睾丸特异性微环境免疫调节剂。因此,明确SLCs与睾丸免疫相互调节的机制,探索新的治疗靶点,增强基于SLCs的细胞治疗势在必行。
巨噬细胞作为睾丸初级固有免疫细胞,在睾丸发育、组织修复和睾丸衰老的病理生理过程中起着至关重要的作用。巨噬细胞和间质细胞之间的细胞间交流有助于生殖细胞发育的良好状态。在稳态条件下,巨噬细胞与精原细胞密切相关,调节类固醇生成,并在精原微环境中发挥作用。此外,巨噬细胞是固有免疫的关键调节因子,负责急性炎症和慢性炎症。睾丸体细胞中与衰老相关的改变还以炎症诱导基因的上调为特征。线粒体是免疫反应的核心。有证据表明,急性和慢性炎症反应与巨噬细胞线粒体功能障碍有关。然而,睾丸巨噬细胞在这种炎症生态位中调节组织稳态的机制需要进一步探索。
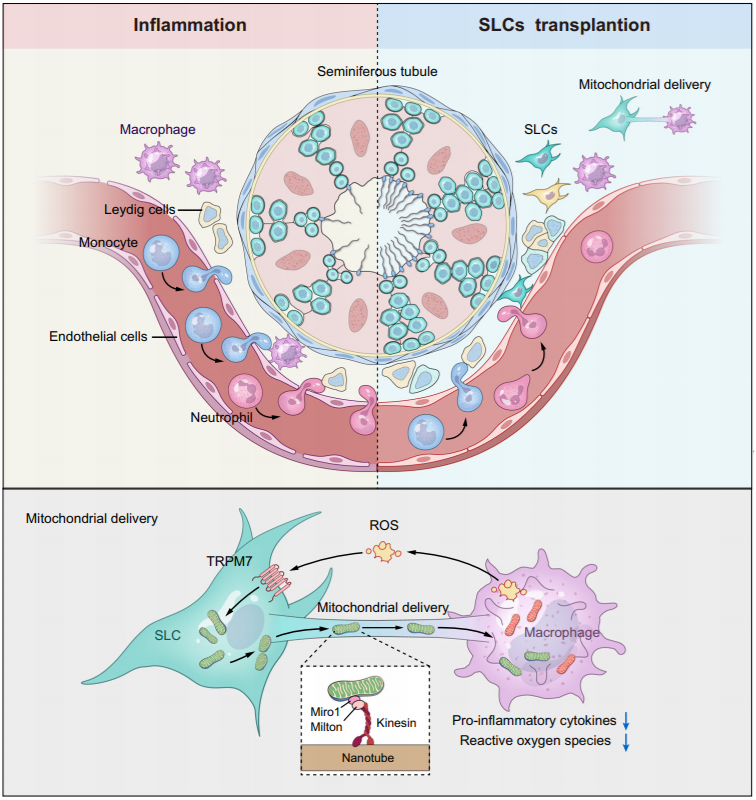
模式图(Credit: Nature Communications)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


