Nature:利用低温电子断层扫描技术揭示Aβ和tau蛋白在阿尔茨海默病患者死后大脑组织中的三维结构
来源:生物谷原创 2024-07-14 10:58
在阿尔茨海默病中,Aβ蛋白斑块和异常的tau丝状物被认为会破坏细胞间的交流,从而导致记忆力减退、意识模糊和细胞死亡等症状。
在一项新的研究中,来自利兹大学的研究人员描述了他们如何在荧光显微镜的引导下,利用低温电子断层扫描技术(cryo-electron tomography)探索阿尔茨海默病供体大脑的深层结构。通过所获得的三维图谱,他们可以观察到大脑中的蛋白。相关研究结果于2024年7月10日在线发表在Nature期刊上,论文标题为“CryoET of β-amyloid and tau within postmortem Alzheimer’s disease brain”。

这项新的研究着重关注两种导致痴呆症的蛋白——β淀粉样蛋白(β-amyloid, Aβ)和tau蛋白,其中Aβ是一种会形成微小粘性斑块的蛋白,而tau蛋白是另一种会在阿尔茨海默病患者体内形成异常丝状物的蛋白,这种丝状物会在细胞内生长并扩散到整个大脑。这些作者揭示了大脑组织中 tau 的分子结构、Aβ的排列方式,以及在大脑病理学中缠结在一起的新分子结构。
痴呆症是英国人死亡的主要原因,其中阿尔茨海默病是最为常见的痴呆症形式。在阿尔茨海默病中,Aβ蛋白斑块和异常的tau丝状物被认为会破坏细胞间的交流,从而导致记忆力减退、意识模糊和细胞死亡等症状。
论文通讯作者、利兹大学生物学院副教授Rene Frank博士说,“这是对人脑内部分子结构的首次窥视,为了解阿尔茨海默病中蛋白的变化提供了进一步的线索,同时也提出了一种实验方法,可用于更好地了解其他多种破坏性神经疾病。”
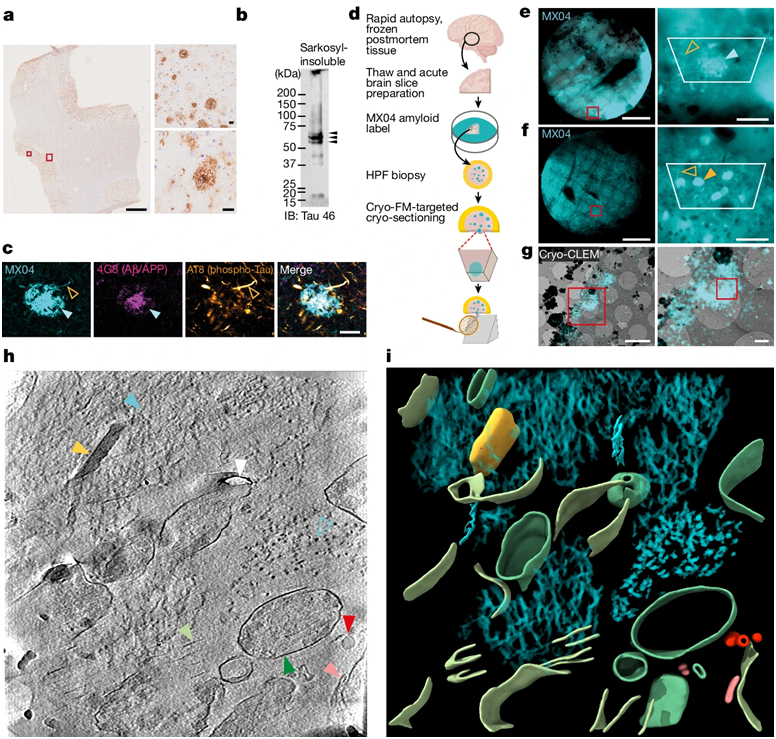
图片来自Nature, 2024, doi:10.1038/s41586-024-07680-x
在过去的 70 年里,全球数千名科学家积累了大量的分子结构目录,他们每个人都在试管中孤立地研究蛋白。然而,人们早已知道,生物学中的大多数功能是许多不同蛋白组合的结果。
这项新的研究是结构生物学家研究蛋白直接在细胞和组织内的天然环境的新努力的一部分,也是研究蛋白如何协同工作和相互影响的一部分,尤其是在饱受疾病摧残的人类细胞和组织中。
从长远来看,人们希望通过观察组织内蛋白的这种相互作用,加快确定下一代基于机制的治疗和诊断的新靶标。(生物谷Bioon.com)
参考资料:
Madeleine A. G. Gilbert et al. CryoET of β-amyloid and tau within postmortem Alzheimer's disease brain. Nature, 2024, doi:10.1038/s41586-024-07680-x.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


