J Extracell Vesicles: 细胞外囊泡将CLCA2转运到细胞核控制角质形成细胞的存活和迁移
来源:生物谷原创 2024-05-13 11:33
CLCA2或RBM3的敲除促进了角质形成细胞的迁移,这两种蛋白都是角质形成细胞在高渗应激下生存所必需的。这可能涉及两种蛋白质的相互作用,正如CLCA2的核定位对这两种活动的重要性所表明的那样。
皮肤作为身体的最外表面,提供了一种基本的屏障,防止病原体、刺激物和过敏原的入侵,并防止过度水分流失。维持皮肤的完整性及其屏障功能需要角质形成细胞之间的紧密连接,角质形成细胞是表皮的主要细胞类型。细胞-细胞接触的改变会影响中央过程,包括角质形成细胞的增殖、迁移和存活。因此,角质形成细胞粘附性受损是特应性皮炎和牛皮癣等主要炎症性皮肤病的标志。
最近发现了跨膜蛋白“氯通道附件2”(CLCA2)在角质形成细胞黏附中的重要作用。CLCA2是人类CLCA家族的三个功能成员之一,最初被发现可能是氯通道活性的调节因子。CLCA2主要以其在乳腺癌中的肿瘤抑制功能而闻名,在乳腺癌中它抑制细胞的迁移和侵袭。
CLCA2在髓核细胞和角质形成细胞中的表达随着高渗应激的增加而增加。这种应激状态存在于表皮屏障功能受损的患者的皮肤中,特别是在干燥的环境中。一致地,CLCA2在特应性皮炎患者的表皮中过度表达,这很可能是一种代偿机制。
角质形成细胞中CLCA2水平的增加对于细胞-细胞接触的稳定是重要的,这从培养的角质形成细胞与CLCA2基因敲除后黏附强度的降低可见一斑。与CLCA2在细胞-细胞接触形成中的作用一致,它被证明在乳腺癌细胞中与细胞黏附蛋白EVA-1相互作用,并在HEK293T细胞中过表达时与黏附连接的一种成分β-连环蛋白相互作用。

图片来源:https://doi.org/10.1002/jev2.12430
近日,来自瑞士苏黎世联邦理工学院分子健康科学研究所生物系的研究者们在J Extracell Vesicles杂志上发表了题为“Transport of CLCA to the nucleus by extracellular vesicles controls keratinocyte survival and migration”的文章,该研究揭示了细胞外囊泡将CLCA2转运到细胞核控制角质形成细胞的存活和迁移。
氯通道辅助蛋白2(CLCA2)是一种跨膜蛋白,能促进角质形成细胞的黏附,促进角质形成细胞在高渗应激下的存活。在本研究中,研究者展示了CLCA2是通过细胞外小泡运输到角质形成细胞的核的。
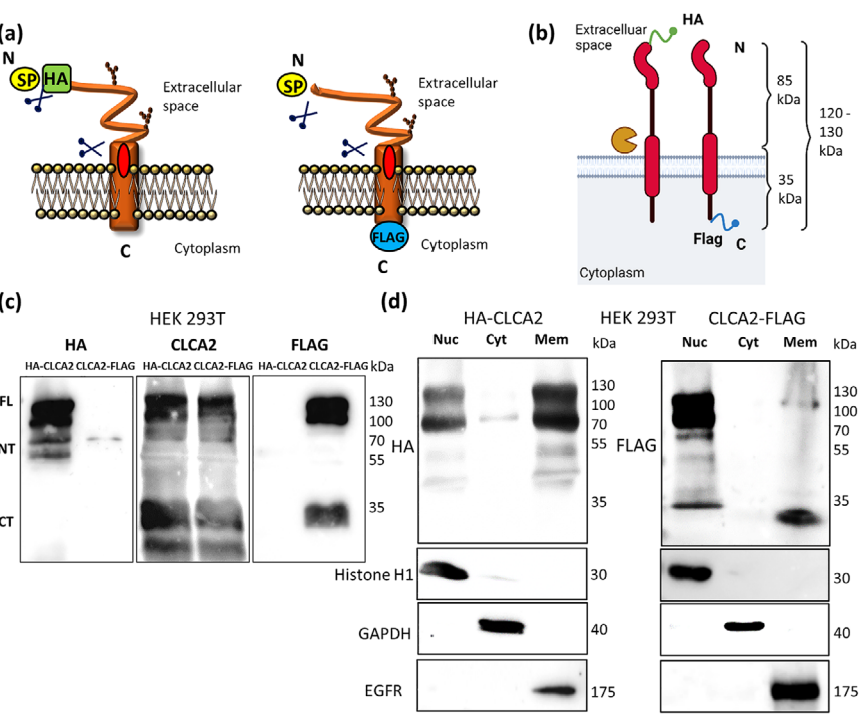
CLCA2定位于细胞膜和胞核
图片来源:https://doi.org/10.1002/jev2.12430
核定位是功能相关的,因为野生型CLCA2,而不是缺乏核定位信号的突变体,抑制角质形成细胞的迁移并保护它们免受高渗应激诱导的细胞死亡。在细胞核中,CLCA2与β-连环蛋白结合并激活,导致WNT靶基因表达增强。基于质谱学的相互作用筛选和功能挽救研究证实,RNA结合蛋白3是核CLCA2的关键效应因子。
这可能与活体相关,因为这两种蛋白质共同定位于人类表皮。综上所述,这些结果确定了在稳态和应激条件下角质形成细胞中CLCA2出人意料的核功能,并提示细胞外小泡及其核运输在控制关键细胞活动中的作用。

CLCA2和RBM3在人表皮中的共定位
图片来源:https://doi.org/10.1002/jev2.12430
CLCA2或RBM3的敲除促进了角质形成细胞的迁移,这两种蛋白都是角质形成细胞在高渗应激下生存所必需的。这可能涉及两种蛋白质的相互作用,正如CLCA2的核定位对这两种活动的重要性所表明的那样。
因此,新的和以前的数据表明,CLCA2通过调节细胞核中未知的基因、RNA或蛋白质来促进暴露于高渗应激下的角质形成细胞的存活,并通过促进细胞与细胞的黏附来确保在这些条件下的表皮完整性,这一活动需要它存在于细胞膜上。
有趣的是,RBM3还赋予不同类型的细胞对各种其他应激源的抵抗力,包括血清撤除、内质网应激和寒冷暴露,并保护细胞免受凋亡。这些细胞保护活性是否也涉及其结合伙伴CLCA2仍有待确定。除了这个开放的问题,本研究工作表明,CLCA2-RBM3的伙伴关系在活体人类皮肤中也是相关的,因为这两种蛋白共同定位于基底和基底上角质形成细胞的细胞核。
最重要的是,之前已经证明,CLCA2在特应性皮炎患者的表皮中强烈表达,它可能保护角质形成细胞免受高渗应激的影响,高渗应激是由于表皮屏障受损而导致的经皮水分丢失。在未来,人们将有兴趣确定这一功能是否需要RBM3,以及CLCA2和RBM3是否通过EVS靶向于健康人和特应性皮炎患者皮肤的角质形成细胞核。最后,未来的研究将揭开CLCA2和RBM3在其他与角质形成细胞缺陷相关的人类皮肤病发病机制中的作用。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


