两篇Cell和两篇Cancer Cell揭示驱动多种癌症生长的关键蛋白及其调控方式
来源:生物谷原创 2023-08-31 10:44
在四项新的研究中,来自美国华盛顿大学、布罗德研究所、杨百翰大学和世界各地其他机构的研究人员的领导下,临床蛋白质组肿瘤分析联盟(Clinical Proteomic Tumor Analysis Con
在四项新的研究中,来自美国华盛顿大学、布罗德研究所、杨百翰大学和世界各地其他机构的研究人员的领导下,临床蛋白质组肿瘤分析联盟(Clinical Proteomic Tumor Analysis Consortium)研究了驱动癌症的关键蛋白及其调控方式。他们完成了对多种肿瘤类型中驱动癌症的蛋白的深入分析,而这些信息仅靠基因组测序是无法评估的。了解了蛋白在癌细胞中的运作方式,就有望开发出阻断驱动癌症生长的关键蛋白的新疗法,或触发对癌细胞产生的异常蛋白的免疫反应的疗法。相关研究结果于2023年8月14日发表在Cell期刊和Cancer Cell期刊的四篇论文中,论文标题分别为“Pan-cancer proteogenomics connects oncogenic drivers to functional states”、“Pan-cancer analysis of post-translational modifications reveals shared patterns of protein regulation”、“Integrative multi-omic cancer profiling reveals DNA methylation patterns associated with therapeutic vulnerability and cell-of-origin”和“Proteogenomic data and resources for pan-cancer analysis”。

华盛顿大学医学教授Li Ding博士说,“在我们开发更好的癌症疗法的努力中,这种对驱动肿瘤生长的蛋白的新分析是继癌症基因组测序之后的下一步。通过过去的癌细胞基因组测序工作,我们确定了近 300 个驱动癌症的基因。如今,我们正在研究这些癌基因启动的机制的细节---它们所产生的蛋白及其调控网络实际上进行着导致细胞分裂失控的工作。我们希望这项分析能成为癌症研究人员开发多种肿瘤类型新疗法的重要资源。”
这些作者分析了涉及10种不同类型癌症的约1万种蛋白。Ding强调了大量数据在这类分析中的重要性;其中许多重要的癌症驱动蛋白在任何一种癌症中都很罕见,如果对每种肿瘤类型进行单独研究,就不可能发现这些蛋白。这项分析包括两种不同类型的肺癌以及结直肠癌、卵巢癌、肾癌、头颈癌、子宫癌、胰腺癌、乳腺癌和脑癌。
Ding说,“许多导致癌症的蛋白存在于多种肿瘤类型中,但出现频率很低。当我们对多种癌症类型进行综合分析时,我们就能提高检测导致癌症生长和扩散的重要蛋白的能力。这种综合分析还能让我们找出驱动不同类型癌症的主要共同机制。”
除了单个蛋白的功能外,这些数据还能让这些作者了解蛋白之间是如何相互作用来促进癌症生长的。如果两种蛋白的水平相互关联---例如,当其中一种蛋白的水平较高时,另一种蛋白的水平也总是很高,这就表明这两种蛋白作为搭档发挥作用。破坏这种相互作用可能是阻止肿瘤生长的一种有效方法。
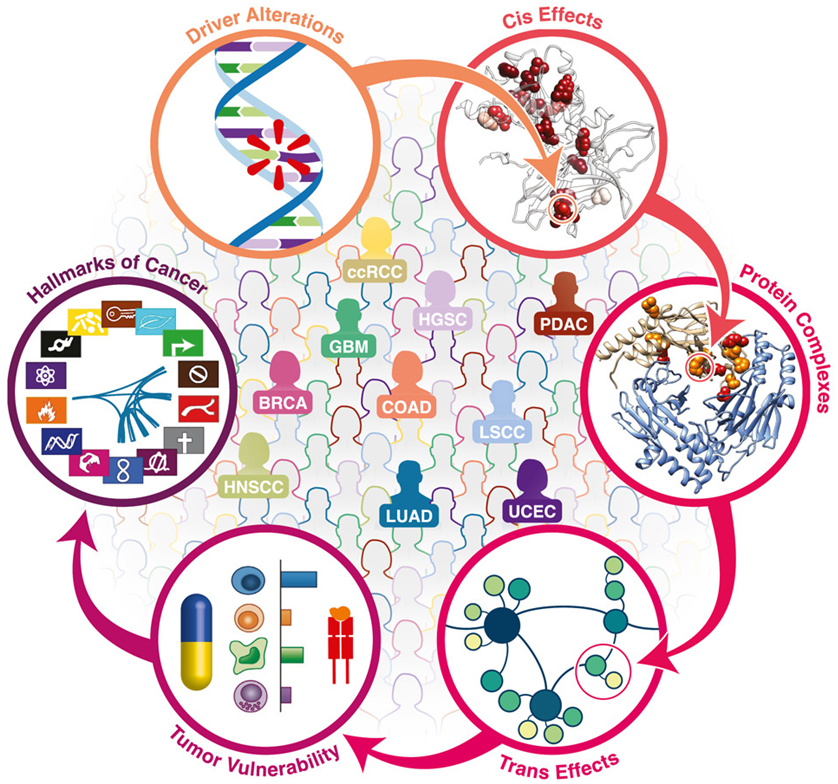
图片来自Cell, 2023, doi:10.1016/j.cell.2023.07.014。
其中的一项研究还揭示了改变蛋白功能的不同化学方法。这些作者记录了这类化学变化---称为乙酰化和磷酸化的过程---如何改变DNA修复、改变免疫反应、改变DNA的折叠和包装方式,以及其他可能在癌症发生过程中发挥作用的重要分子变化。
第二项研究还揭示了免疫疗法的有效性。免疫检查点抑制剂等免疫疗法通常对突变较多的癌症最有效,但即便如此,它们也并非对所有患者都有效。这些作者发现,大量突变并不总是导致异常蛋白的大量存在,而异常蛋白正是免疫系统攻击肿瘤的靶标。
Ding说,“对某些癌症来说,即使突变有可能产生肿瘤抗原,但如果没有异常蛋白表达或表达很少,这种突变就可能不是治疗的靶标。这可以解释为什么有些患者对免疫疗法没有反应,即使他们似乎应该对免疫疗法有反应。因此,我们的蛋白质组学研究涵盖了肿瘤抗原的表达谱,对于设计针对选定突变的新免疫疗法特别有用。”
在另一项研究中,Ding及其团队确定了DNA甲基化模式,这是另一种能影响基因表达方式的化学变化。这种模式可能是癌症的关键驱动因素。在一项重要发现中,他们确定了在某些肿瘤类型中抑制免疫系统的分子开关。最后一项研究向更广泛的研究界提供了临床蛋白质组肿瘤分析联盟使用的数据和分析资源。
Ding说,“总体来说,这种对多种癌症类型进行的全面蛋白质组和化学修饰分析,再加上我们长期积累的癌症基因组学知识,为我们提供了另一层信息,我们希望这可以帮助回答持续存在的许多关于癌症如何生长和设法逃避我们许多最佳治疗的问题。” (生物谷 Bioon.com)
参考资料:
1. Yize Li et al. Pan-cancer proteogenomics connects oncogenic drivers to functional states. Cell, 2023, doi:10.1016/j.cell.2023.07.014.
2. Yifat Geffen et al. Pan-cancer analysis of post-translational modifications reveals shared patterns of protein regulation. Cell, 2023, doi:10.1016/j.cell.2023.07.013.
3. Wen-Wei Liang et al. Integrative multi-omic cancer profiling reveals DNA methylation patterns associated with therapeutic vulnerability and cell-of-origin. Cancer Cell, 2023, doi:10.1016/j.ccell.2023.07.013.
4. Yize Li et al. Proteogenomic data and resources for pan-cancer analysis. Cancer Cell, 2023, doi:10.1016/j.ccell.2023.06.009.
5. Scientists reveal how proteins drive growth of multiple cancer types
https://medicine.wustl.edu/news/scientists-reveal-how-proteins-drive-growth-of-multiple-cancer-types/
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


