“癌干细胞”重要调节因子!中国医科大学马晓欣团队:发现癌症治疗新途径
来源:转化医学网 2024-07-29 16:41
7月23日,中国医科大学马晓欣研究团队在期刊《Journal of Experimental & Clinical Cancer Research》上发表了研究论文,题为“WTAP

7月23日,中国医科大学马晓欣研究团队在期刊《Journal of Experimental & Clinical Cancer Research》上发表了研究论文,题为“WTAP/IGF2BP3 mediated m6A modification of the EGR1/PTEN axis regulates the malignant phenotypes of endometrial cancer stem cells”,本研究中,研究人员发现WTAP和m6A的水平在子宫内膜癌和子宫内膜干细胞中均降低,并且敲低WTAP促进了子宫内膜癌和子宫内膜干细胞的特性,包括增殖,侵袭,迁移,顺铂耐药性和自我更新。WTAP的下调导致EGR1 mRNA的m6A修饰减少,IGF2BP3作为m6A阅读器难以识别和结合失去m6A修饰的EGR1 mRNA,导致EGR1 mRNA的稳定性降低。EGR1水平的降低导致了抑癌基因PTEN表达的降低,从而致使细胞内稳态的失调和丧失,进而培养了EC干细胞的特性。值得注意的是,WTAP, EGR1和PTEN的强制过表达抑制了ECCs和ECSCs的体内致癌作用,而WTAP + EGR1和EGR1 + PTEN的联合过表达进一步降低了这些细胞的致瘤潜能。本研究结果揭示了WTAP/EGR1/PTEN通路是子宫内膜癌干细胞维持、化疗耐药和肿瘤发生的重要调节因子,为子宫内膜癌的治疗提供了新的和有前景的治疗途径。

https://jeccr.biomedcentral.com/articles/10.1186/s13046-024-03120-w#Sec34
背景知识
01
子宫内膜癌(EC)是发达地区最常见的妇科恶性肿瘤,全球每年约有76000名女性死于该病。虽然所有年龄组的确诊病例数都有所增加,但40岁以下女性的子宫内膜癌病例数增加了一倍。尽管早期诊断和手术、化疗和免疫治疗策略的整合提高了患者的生存率,但晚期或复发性子宫内膜癌患者的治疗效果仍不理想,预后不良。因此,阐明子宫内膜癌发生发展的机制,寻找靶向治疗药物具有重要意义。
肿瘤干细胞(CSCs)是一类特殊的肿瘤细胞亚群,具有自我更新、多能性、增殖、转移、免疫逃逸和化疗耐药等特点。肿瘤干细胞的鉴定和检测极大地提高了对恶性肿瘤的认识和治疗方法。研究表明,可以从雌激素依赖的人子宫内膜癌细胞系(EC)中提取EC干细胞(ECSCs)。越来越多的文献强调了ECSCs在EC进展中的关键作用,确定了未来研究和潜在治疗干预的关键领域。
近年来,表观遗传机制在肿瘤发生和进化中的关键作用越来越受到人们的重视。n6 -甲基腺苷(m6A)是真核细胞中最常见的转录后RNA修饰,甲基转移酶样3 (METTL3)、甲基转移酶样14 (METTL14)和肾母细胞瘤1相关蛋白(WTAP)共同构成m6A甲基化酶复合体。WTAP有助于m6A甲基化酶复合物的核定位,促进METTL3和METTL14的募集。去甲基化主要包括2种去甲基化酶,肥胖相关蛋白(FTO)和alkB同源物5 (ALKBH5)。WTAP在m6A修饰中发挥重要作用,并在肿瘤发生发展中发挥关键作用。近年来,越来越多的研究表明m6A修饰在肿瘤干细胞中发挥重要作用。
EGR1的下调是维持ECSC表型所必需的
02
TCGA-UCEC配对样本的数据分析显示,与正常组织相比,EC中EGR1的表达显著降低。来自GSE17025数据集的数据也证实了这一发现,该数据集也表明EGR1在EC中的表达降低。研究还显示EC组织中的EGR1水平低于正常组织。EGR1的降低与FIGO分期、淋巴结转移和淋巴转移进展有关。免疫组化评价进一步证实,与正常组织相比,EC组织中EGR1的表达降低。EGR1的下调被认为是维持ECSC表型所必需的。功能分析表明,ECCs和ECSCs中的EGR1过表达增加了细胞对顺铂的敏感性,而EGR1敲低则降低了这种敏感性。CCK-8实验显示,在ECCs和ECSCs中,EGR1过表达会降低细胞增殖,而EGR1敲低则会增加细胞增殖。评估细胞侵袭和转移能力的迁移试验显示,在ECCs和ECSCs中,EGR1过表达阻碍了这些过程,而EGR1敲低促进了这些过程。凋亡分析表明,EGR1过表达增强了细胞凋亡,而EGR1敲低抑制了ECCs和ECSCs的凋亡事件。球体形成试验用于评估ECSC的自我更新能力,结果表明EGR1表达降低是ECSC维持的特征。EGR1的过表达抑制了内皮细胞的自我更新,而EGR1的下调促进了内皮细胞的自我更新。免疫印迹实验进一步验证了这些发现,显示EGR1过表达抑制了干性标志物NANOG和SOX2的表达,而EGR1敲低则增加了。这些综合的分析阐明了EGR1在调节子宫内膜癌的各种细胞过程中的关键作用,包括对化疗的敏感性,增殖,侵袭,转移,凋亡和维持干细胞特性。
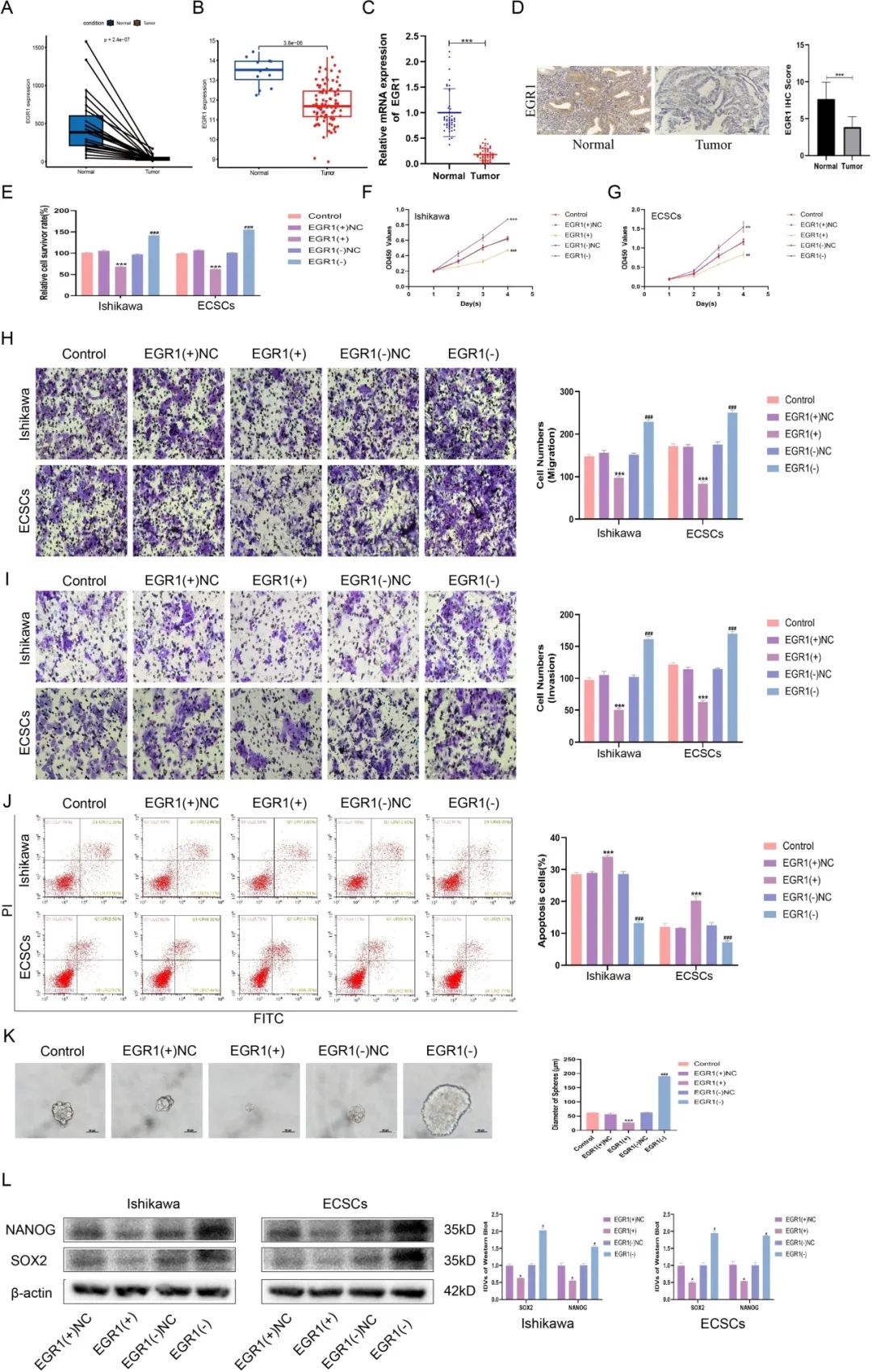
EGR1在子宫内膜癌中表达下调,并促进子宫内膜癌和子宫内膜干细胞的恶性行为
为了证实WTAP, EGR1和PTEN在体内肿瘤生长中的作用,研究人员通过在ECCs和ECSCs中分别过表达WTAP, EGR1和PTEN,或联合过表达WTAP + EGR1或EGR1 + PTEN构建裸鼠移植瘤模型。结果显示,与对照组相比,单独过表达WTAP、EGR1或PTEN组的平均移植瘤体积显著减小,而联合过表达WTAP + EGR1和EGR1 + PTEN组的平均移植瘤体积最小。同样,与对照组相比,单独过表达WTAP、EGR1或PTEN均可显著降低裸鼠移植瘤的平均重量,且WTAP + EGR1和EGR1 + PTEN联合过表达组的平均重量最低。另外,裸鼠移植瘤免疫组织化学染色显示,与对照组相比,单独过表达WTAP、EGR1或PTEN可显著降低裸鼠移植瘤中Ki-67、NANOG和SOX2的表达,其中WTAP + EGR1组和EGR1 + PTEN组中Ki-67、NANOG和SOX2的表达最低。最后,研究人员总结了WTAP/EGR1/PTEN轴在EC中作为调控EC干细胞干细胞维持的机制图的作用。这些实验结果为WTAP, EGR1和PTEN在子宫内膜癌中调节肿瘤生长和维持干细胞样特征提供了有力的证据。异种移植模型的结果肯定了靶向WTAP/EGR1/PTEN轴作为一种策略方法来抑制子宫内膜癌的肿瘤进展和干细胞驱动的肿瘤增殖的潜力。
研究小结
03
综上,本研究阐明了WTAP/EGR1/PTEN轴的关键作用,它的抑制导致细胞调节的丧失,从而促进子宫内膜癌的恶性和维持干细胞特性。另外,体内实验加强了WTAP/EGR1/PTEN轴在子宫内膜癌治疗中的临床相关性。该轴的过表达具有良好的减缓EC进展的潜力,突出了该轴作为对抗这种疾病的一个有前景的治疗靶点。本发现为EC的分子基础提供了有价值的见解,并提出了一种新的治疗策略,即通过靶向WTAP/EGR1/PTEN调控机制来抑制其进展。
参考资料:
https://jeccr.biomedcentral.com/articles/10.1186/s13046-024-03120-w#Sec34
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


