《自然·医学》:MSKCC发布肺癌液体活检重磅成果!大型国际队列证实,ctDNA可有效预测非小预后并指导靶向治疗
来源:奇点糕 2022-11-16 09:40
近年来,受益于靶向治疗,非小细胞肺癌(NSCLC)患者的治疗和预后有了极大改善,这也主要依托组织测序的广泛应用,但在真实世界中,由于各种原因无法进行组织测序的患者很多[1-3],
近年来,受益于靶向治疗,非小细胞肺癌(NSCLC)患者的治疗和预后有了极大改善,这也主要依托组织测序的广泛应用,但在真实世界中,由于各种原因无法进行组织测序的患者很多[1-3],于是,更易于获取样本并进行检测的血液循环肿瘤DNA(ctDNA)“顺势上位”。
不过,年轻的ctDNA也还存在一些不确定性,比如,经ctDNA匹配到的靶向治疗与组织测序匹配到的缓解率相近,但研究主要在小型队列中进行,且没有足够的随访时间来确定其能否转化为同样的总生存期获益,还有,ctDNA可以反映肿瘤侵袭性和疾病负担,但它预测预后的价值是否是独立于肿瘤体积或其他临床因素存在的呢?解决了这些问题,ctDNA才能“更上一层楼”。
今天,《自然·医学》杂志刊登了一项研究结果[4],纪念斯隆·凯特林癌症中心(MSKCC)的研究人员在一项大型前瞻性NSCLC国际队列中,验证了ctDNA阳性结果与更低的总生存率(OS)有关(HR=2.05,p<0.001),且独立于临床病理特征和肿瘤代谢体积,接受ctDNA测序后匹配的靶向治疗的患者相比未接受的,OS更高(HR=0.63,p<0.001)。
研究人员在1/4的患者中发现了组织测序未检测到的ctDNA基因组变异,它们表征了一些驱动耐药性的基因变异,包括RICTOR和PIK3CA变异。
这项研究表明,ctDNA不仅可以指导治疗决策,它本身也具有预测预后的价值。

这项研究共纳入了1127例IV期或复发性NSCLC患者,要么在入组前没有已知的驱动突变,要么在靶向治疗后疾病进展。
所有患者都接受了ctDNA测序,血样在入组第一天获取,患者可自行选择在之后再次提供血样,不过大部分(89%)患者只提供了一次血样。所有在MSKCC登记的患者都进行了组织测序。患者可根据个人意愿接受额外的血浆循环游离DNA(cfDNA)测序。
与组织相比,ctDNA测序的失败率更低,周转时间更短。1219次组织测序中有164次(13%)因材料不足或测序失败而失败,而1919次血浆测序(ctDNA或cfDNA)中只有37次(2%),有2例患者血浆和组织测序均未成功。从样本采集到得到测序报告,组织测序花费了33天,而血浆测序仅为11天。
64%(722/1127)的患者至少有一种ctDNA变异,有ctDNA变异的患者OS较低(HR=2.05,p<0.001),这一结果可以推广到MSKCC和悉尼队列的初治和经治患者中,并且ctDNA变异数量越多,OS越低。一些患者只有影响不明的变异,但他们和没有变异的相比,OS也更低,这表明,即使没有致病性变异,ctDNA阳性结果也预示着更差的预后。
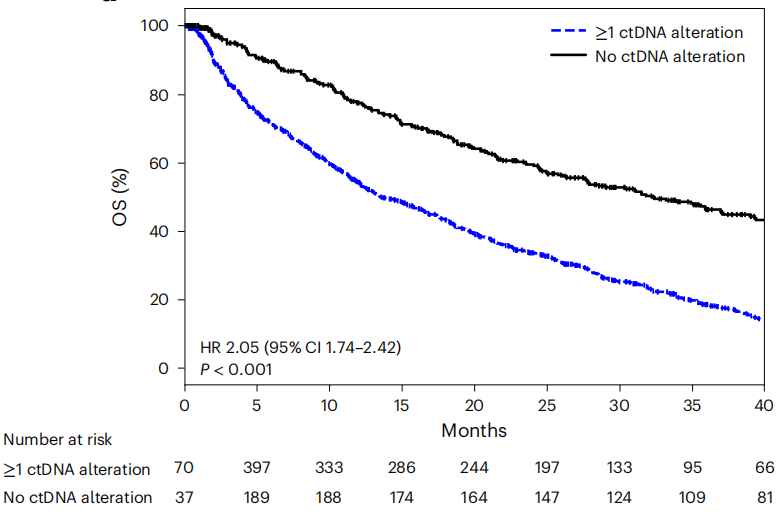
有ctDNA变异(蓝)和无变异的患者的OS
肿瘤突变负荷(TMB)与ctDNA无关,在接受靶向治疗、免疫治疗或化疗的患者中,ctDNA均是更差预后的独立预测因素。因此,ctDNA的预测作用独立于治疗模式和肿瘤基因组学。
除这两者外,多个多变量分析还证实了,ctDNA具有独立于肿瘤代谢体积等多种因素的独立预后价值。
在得到测序结果后,共有418例(37%)患者接受了靶向治疗,其中255例(23%)经ctDNA匹配,163例(14%)经组织测序匹配。所有接受靶向治疗的患者中,可检测到ctDNA的OS较低,经ctDNA匹配到靶向治疗的患者相比未接受靶向治疗的,OS提高(HR=0.63,p<0.001),而未检测到ctDNA的,是否接受靶向治疗不影响OS。
这表明,在ctDNA阳性的患者中,靶向治疗具有更大的相对获益。
429例在ctDNA测序后30天内接受组织测序的患者中,109例(25%)只在ctDNA测序中检测到突变或拷贝数变化,其中有3例为EGFR T790M突变,患者因此转换治疗,其他可靶向突变还包括1例KRAS G12C突变、1例BRAF V600E突变和1例RET融合,但没有转换治疗。
这种仅具有ctDNA检测到的变异的患者,相比具有同时能够被ctDNA和组织测序检测到的变异的患者,OS降低,无论是突变还是拷贝数变化,结果都是一致的。这表明,仅ctDNA能检测到的变异也是较为常见的,并且同样具有预测预后的价值。
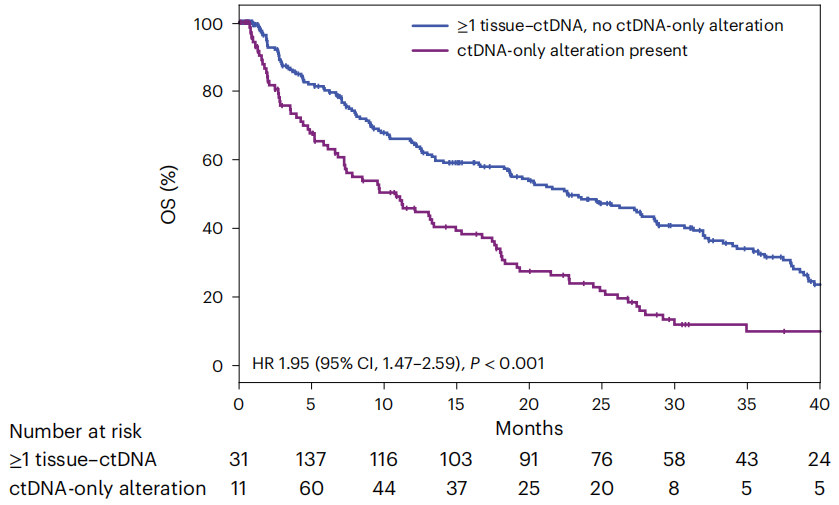
仅ctDNA检测到变异的患者(紫)与ctDNA和组织测序均检测到变异的患者(蓝)的OS
研究人员发现的仅ctDNA检测到的变异其实也是组织中的常见变异,这些变异中,继发性耐药基因的比例很高,尤其是RICTOR、NTRK1、MET和ERBB2扩增和PIK3CA突变。
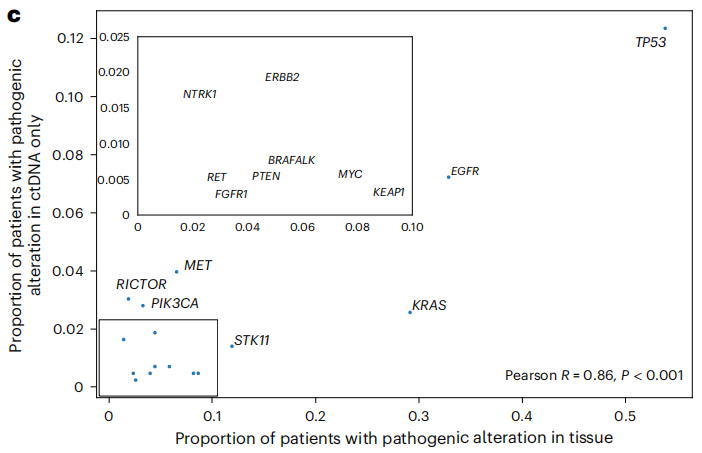
仅ctDNA和组织变异中,致病性变异的基因水平的分布
这些继发性耐药基因变异通常与更糟糕的预后有关,但分析结果显示,检测到有ALK、RET和EGFR变异的患者有较高的OS,有STK11变异的患者有较低的OS,而RICTOR、NTRK1、MET和ERBB2和PIK3CA变异与较低的OS没有关联。这表明,ctDNA-组织测序结果的差异是一个关键预后因素,而不是基因组变异。
总的来看,这项研究表明,ctDNA一方面可以指导NSCLC患者的靶向治疗用药,改善患者预后,另一方面还可以作为一个独立的OS预测因素,它是肿瘤微转移或肿瘤侵袭性增加的标志,在评估系统性治疗后的疾病负担和复发风险时,可与放射性检查结果结合。
当然,这些结果也给研究人员提出了新的问题,比如,为什么ctDNA阴性的患者OS更高?是因为他们的肿瘤增殖缓慢吗?是否与影响药物摄取的肿瘤微环境特定特征有关?我们能否通过药物将ctDNA阳性转变为阴性?这些问题需要基于ctDNA动力学,分别从肿瘤和患者入手,来阐明其中的临床和生物学机制[5]。
参考文献:
[1] Bruno D S, Hess L M, Li X, et al. Racial disparities in biomarker testing and clinical trial enrollment in non-small cell lung cancer (NSCLC)[J]. J Clin Oncol, 2021.
[2] Robert N J, Nwokeji E D, Espirito J L, et al. Biomarker tissue journey among patients (pts) with untreated metastatic non-small cell lung cancer (metastatic NSCLC) in the US Oncology Network community practices[J]. J Clin Oncol, 2021, 39.
[3] Zugazagoitia J, Ramos I, Trigo J M, et al. Clinical utility of plasma-based digital next-generation sequencing in patients with advance-stage lung adenocarcinomas with insufficient tumor samples for tissue genotyping[J]. Annals of Oncology, 2019, 30(2): 290-296.
[4] https://www.nature.com/articles/s41591-022-02047-z
[5] https://www.nature.com/articles/s41591-022-02068-8
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


