专访密歇根大学朱贵志|开发新型水凝胶纳米疫苗,动物试验单剂原位注射治疗肿瘤疗效显著,已落地公司推进技术转化
来源:生辉 2023-08-08 15:37
近期,密歇根大学朱贵志教授、广州医科大学郭伟圣教授和中山大学林水宾教授联合开发出一种单剂注射水凝胶纳米疫苗,能够减少肿瘤微环境中的细胞和分子免疫抑制,在大肿瘤和远端肿瘤中展现出较好的疗效。目前,这项研
传统的肿瘤治疗方法,比如放疗、化疗等都是通过外源性方式杀死肿瘤细胞来达到治疗目的,但这往往也会对机体正常细胞造成较大损伤,与之不同的是,肿瘤免疫疗法通过激活或增强机体免疫系统攻击肿瘤细胞实现治疗目的。
近年来,免疫疗法已成为继传统手术、放疗、化疗之后治疗肿瘤的一种常用手段,常见的比如免疫检查点阻断疗法、细胞因子疗法、嵌合抗原受体 T 细胞或巨噬细胞疗法、以及肿瘤疫苗等。
以免疫检查点阻断疗法为例,其通过阻断肿瘤细胞和免疫细胞之间的信号通路来激活免疫系统攻击肿瘤细胞,目前已在多种类型的肿瘤治疗中表现出显著疗效,然而,由于肿瘤免疫抑制性微环境的影响该疗法只适用于少数患者,相较之下,原位肿瘤疫苗可以减少肿瘤微环境免疫抑制进而提高肿瘤免疫治疗效果。
近期,密歇根大学朱贵志教授、广州医科大学郭伟圣教授和中山大学林水宾教授联合开发出一种单剂注射水凝胶纳米疫苗,能够减少肿瘤微环境中的细胞和分子免疫抑制,在大肿瘤和远端肿瘤中展现出较好的疗效。目前,这项研究已经以“Single-dose injectable nanovaccine-in-hydrogel for robust immunotherapy of large tumors with abscopal effect”为题发表在 Science Advances 上。
(来源:Science Advances)
“在临床实践中,病人的肿瘤发现时往往已处于中晚期,常伴随肿瘤细胞转移,这给肿瘤治疗带来了巨大挑战。此次,我们开发的这种‘水凝胶纳米疫苗’在多种可进行原位疫苗接种的局部或转移性实体肿瘤的联合免疫治疗方面具有巨大潜力。”该论文共同通讯作者、密歇根大学朱贵志教授告诉生辉。
朱贵志在佛罗里达大学医学院获得医学博士学位,期间师从谭蔚泓院士,博士毕业后他进入美国国立卫生研究院师从陈小元教授从事博士后工作,研究方向主要围绕纳米肿瘤免疫治疗。目前,他是密歇根大学药学院 Ara G. Paul 冠名终身副教授,密歇根大学生物界面研究所、脑癌生物创新中心的主要成员,以及美国癌症协会研究学者。
现阶段,他课题组专注于研发基于环状 RNA(circRNA)和寡核酸的免疫治疗药物及疫苗,用于基因、ADAR 碱基编辑的 mRNA 药物,以及用于核酸药物递送的生物材料和分子工具。截至目前,他已在 Science Advances、Nature Communications、PNAS、Advanced Science、JACS、ACS Nano 等期刊发表论文 100 余篇,引用次数超 1 万次,拥有多项技术专利,此外,他还曾获得美国国立卫生研究院 MIRA 奖、美国药学科学家协会新兴领袖奖、寡核酸药物学会青年研究学者奖、METAvivor 青年研究员奖等。

▲图|密歇根大学药学院药物科学系朱贵志教授(来源:受访者)
单剂 NvIH 原位注射可高效治疗大肿瘤及转移肿瘤
“肿瘤免疫疗法可以说是肿瘤治疗领域的一个里程碑,然而目前的免疫疗法,例如免疫检查点阻断,仅能够使一小部分患者受益,部分原因是免疫抑制性肿瘤微环境以及由此导致的抗肿瘤 T 细胞的肿瘤浸润不足。”朱贵志表示。
基于肿瘤相关抗原和新抗原的肿瘤疫苗可激活抗原特异性抗肿瘤 T 细胞反应,从而抑制肿瘤生长。“但是,这种肿瘤疫苗可能会面临肿瘤抗原异质性高、肿瘤免疫抑制性微环境、无法有效实现佐剂和抗原向抗原呈递细胞共同递送等阻碍。”他指出。
“通过肿瘤内注射免疫佐剂等来降低肿瘤微环境的免疫抑制性并利用肿瘤抗原激活系统性抗肿瘤免疫的原位疫苗是一种较有前景的肿瘤免疫治疗策略。”朱贵志说道。例如,Toll 样受体 9 激动剂 CpG、IL-2 和 IL-12 等作为原位疫苗佐剂已在临床前或临床试验中被证实可激活肿瘤患者的系统性免疫反应,实现对转移瘤的有效疗效。
Toll 样受体(TLR)是参与非特异性免疫的一类重要蛋白质分子,也是连接非特异性免疫和特异性免疫的桥梁。当微生物突破机体的物理屏障,如皮肤、粘膜等时,TLR 可以识别它们并激活机体产生免疫细胞应答。
“与传统肿瘤疫苗有所不同,原位肿瘤疫苗不需要进行肿瘤抗原筛选和体外制备,因此具有好的临床应用前景。”朱贵志说道,“然而,由于缺乏有效的递送载体,免疫佐剂的活性和利用度受到限制,同时抗原呈递细胞对肿瘤抗原摄取不足,导致需要提高剂量和给药次数。”他补充道。
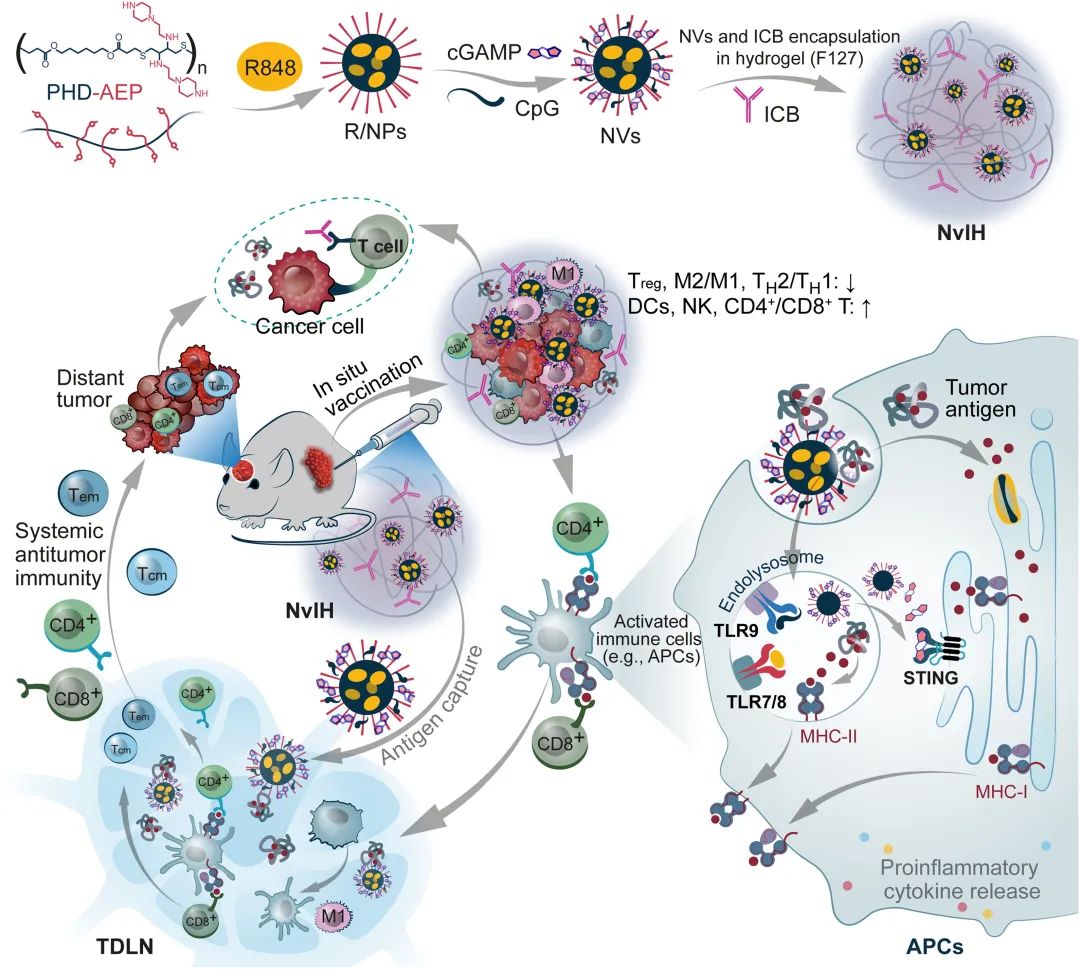
▲图|单剂量 NvIH 原位肿瘤疫苗可高效治疗大肿瘤和远端肿瘤(来源:Science Advances)
“针对上述这些问题,我们以水凝胶-纳米颗粒复合药物递送系统作为载体,开发出一种单剂量水凝胶+纳米疫苗+ICB(NvIH)注射剂,用于大肿瘤和远端肿瘤(转移)的高效治疗。”朱贵志介绍说。
在这项研究中他们发现,接种单剂量的这种 NvIH 原位肿瘤疫苗可有效降低肿瘤微环境的免疫抑制性细胞 Treg 和 MDSCs 的亚群,降低 Treg/CD8+ T 细胞和 M2/M1 型巨噬细胞的比率,同时增加 NK 细胞、CD8+ T 细胞亚群。
“得益于纳米颗粒优异的肿瘤抗原捕获和递送能力,单剂量 NvIH 可显著增加肿瘤引流淋巴结中肿瘤抗原的积累,促进抗原提呈细胞成熟和对抗原的交叉提呈,激活系统性抗肿瘤免疫反应和免疫记忆。”他指出。
与此同时,在多个低免疫原性肿瘤小鼠模型中(Balb/c:4T1 乳腺癌;C57BL/6:B16F10 黑色素瘤、GL261 胶质母细胞瘤),单剂量 NvIH 原位肿瘤疫苗显著增强了肿瘤治疗效果并提高了肿瘤完全消退的比例,同时具有较好的远端肿瘤治疗效果。
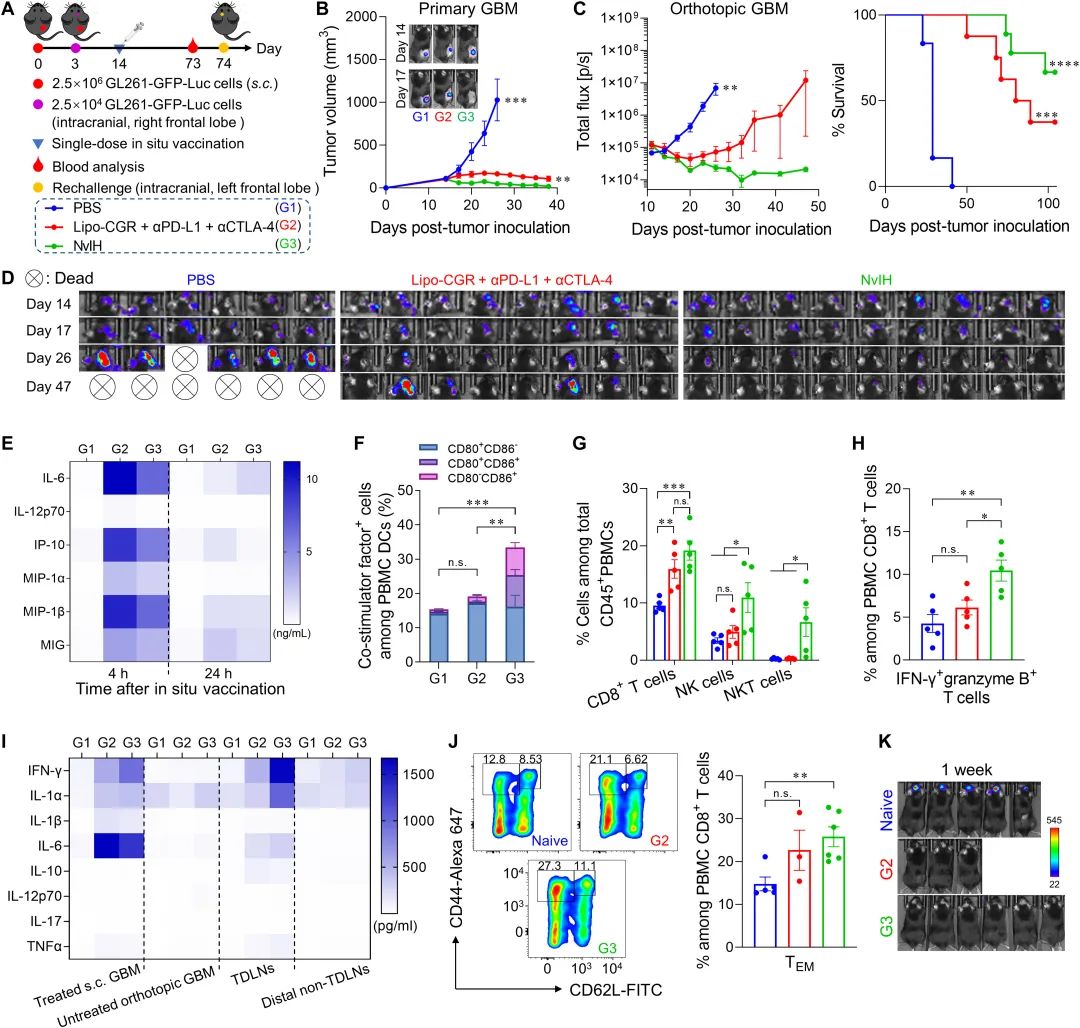
▲图|单剂量 NvIH 原位肿瘤疫苗接种小鼠试验(来源:Science Advances)
值得一提的是,在 GL261 胶质母细胞瘤小鼠模型中,尽管存在血脑屏障和肿瘤免疫抑制性微环境,但单剂量 NvIH 不仅能完全消退所有皮下肿瘤,而且能通过激活系统性抗肿瘤免疫大幅度提高原位肿瘤的治愈率。
“此外,在肿瘤完全消退的小鼠中,优异的抗肿瘤免疫记忆使小鼠能够抵抗肿瘤再挑战实验,有效防止肿瘤复发并提高生存周期。”朱贵志指出。
总的来说,这种单剂量 NvIH 原位肿瘤疫苗能够重塑免疫环境,减少肿瘤微环境中的细胞和分子免疫抑制,引发具有记忆的抗肿瘤 T 细胞反应,在局部和远端肿瘤治疗中具有较大潜力。
已联合创办公司推进技术转化
围绕此次开发的 NvIH 原位肿瘤疫苗,谈及下一步的研究动向,朱贵志表示,“后续将对这种水凝胶-纳米疫苗长期保存的稳定性、系统性免疫相关不良事件等进行综合全面评估,同时,优化载体设计来进一步提高载体捕获和递送抗原的能力,降低药物剂量。”他说道。
临床应用方面,在朱贵志看来现阶段还需要克服几个难题,例如刚刚提到的纳米疫苗在水凝胶中长期保存的稳定性,以及对于实体瘤如何便捷高效注射疫苗,如何精确控制疫苗释放速率等。
“此外,虽然这种 NvIH 原位肿瘤疫苗在乳腺癌、皮肤癌等肿瘤免疫治疗方面展现出巨大潜力,但在包括血癌以及许多无法通过手术进行原位接种的肿瘤治疗方面仍存在局限性,围绕这些方面的研究还有待进一步探索。”他指出。
围绕肿瘤疫苗的开发,朱贵志介绍了当前所面临的一些挑战以及今后的优化方向。“为了有效诱导抗肿瘤免疫反应,肿瘤疫苗必须向抗原呈递细胞输送足量优质抗原以及免疫激活型佐剂,有效激活抗原呈递细胞加工、呈递抗原,诱导强而持续的 CD4+ T 辅助细胞和细胞毒性 CD8+ T 淋巴细胞反应。”他说道。
“如何快速高效鉴别肿瘤特异性抗原,如何将抗原与佐剂共递送至抗原呈递细胞,如何诱导持久的肿瘤特异性 T 细胞反应,如何克服肿瘤的异质性和肿瘤抑制性微环境,是当前肿瘤疫苗开发亟待解决的挑战。”他说道,“针对这些问题,突破口需要从两方面入手,第一,是肿瘤特异性抗原筛选,第二,是递送载体开发。”他补充说。
朱贵志课题组长期从事免疫治疗药物及疫苗的研发工作,除了此次新开发的 NvIH 原位肿瘤疫苗,“我们开发的环状 RNA 疫苗可以有效延长免疫刺激时间,提高抗肿瘤免疫反应,也具有较好的临床应用前景。”朱贵志介绍说。
(来源:Journal of Controlled Release)
围绕环状 RNA,朱贵志团队曾围绕 circRNA 合成的方法,以及目前开发合成 circRNA 作为新兴的 RNA 药物和疫苗等多个方面的研究进行了综述。目前,这篇论文已经以“Circular RNA: An emerging frontier in RNA therapeutic targets, RNA therapeutics, and mRNA vaccines”为题发表在 Journal of Controlled Release 上。
产业层面,朱贵志于 2021 年联合创立了一家名为“AmpedRNA Biosciences”的生物技术公司,并担任首席科学官,现阶段,该公司主要专注于 RNA 药物和疫苗开发。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。




