《细胞发现》:海军军医大学三附院团队揭示AFP阳性肝癌难治之迷!
来源:奇点糕 2023-07-17 11:19
王红阳团队的这项研究成果让我们对AFP阳性肝癌的免疫微环境有了深入的认知,还部分地揭开了AFP阳性肝癌对免疫治疗反应稍好的原因。
甲胎蛋白(AFP)大家一定不陌生。
很多体检套餐里都包含这个指标,它是筛查和诊断肝癌的重要血液标志物。
科学家很早就发现,与AFP阴性肝癌(ANHC,AFP<20ng/mL)患者相比,AFP阳性肝癌(APHC,AFP≥20ng/mL)患者的肿瘤往往更大、血管侵犯较多、分期也较晚[1]。由于AFP阳性肝癌约占所有肝癌的75%左右,非常有必要了解AFP与肝癌之间的关系。
虽然已经有一些研究发现AFP本身就存在一定的促癌作用,但是AFP阴性肝癌和AFP阳性肝癌在分子和免疫层面究竟有哪些差异,目前仍知之甚少。
近日,由海军军医大学第三附属医院王红阳和文文领衔的研究团队,在著名期刊《细胞发现》上发表一项重要研究成果[2]。
他们利用单细胞RNA测序技术研究了AFP阴性肝癌和AFP阳性肝癌的肿瘤组织,发现AFP阳性肝癌的肿瘤组织中存在多方面的免疫抑制。
更重要的是,他们在AFP阳性肝癌的肿瘤组织中发现了一个独特的肿瘤相关巨噬细胞(TAM)亚型——表达SPP1的TAM(TAM-SPP1+),而且确定了SPP1通过与T细胞表面的CD44结合,抑制T细胞的抗癌功能,靶向阻断SPP1/CD44通路可以恢复T细胞的功能,抑制肿瘤的生长,而且联合使用免疫检查点抑制剂,可以进一步提升其抗肿瘤效果。

论文首页截图
王红阳团队首先基于两个临床队列,了解了AFP阴性肝癌和AFP阳性肝癌的临床和病理特征。
根据一个涉及55422人的队列,他们首先证实AFP阳性肝癌占比确实在75%左右。和之前的研究一样,AFP阳性肝癌呈现出更具侵略性的生物学行为,例如具有更高的纤维化分数、TNM分级和临床分期等。无论是否进行手术或辅助治疗,AFP阳性肝癌的中位总生存期(OS)比AFP阴性肝癌短得多(13个月 VS 48个月)。
他们还分析了在海军军医大学第三附属医院接受原发性肝癌根治性肝切除术的297名患者的数据,也发现与AFP阴性肝癌患者相比,AFP阳性肝癌患者的OS和无病生存期(DFS)较差(APHC vs ANHC:OS,39个月 vs 未评估;DFS,11个月 vs 50个月)。
以上数据表明,AFP阳性肝癌确实比AFP阴性肝癌恶性程度更高,患者的预后更差。
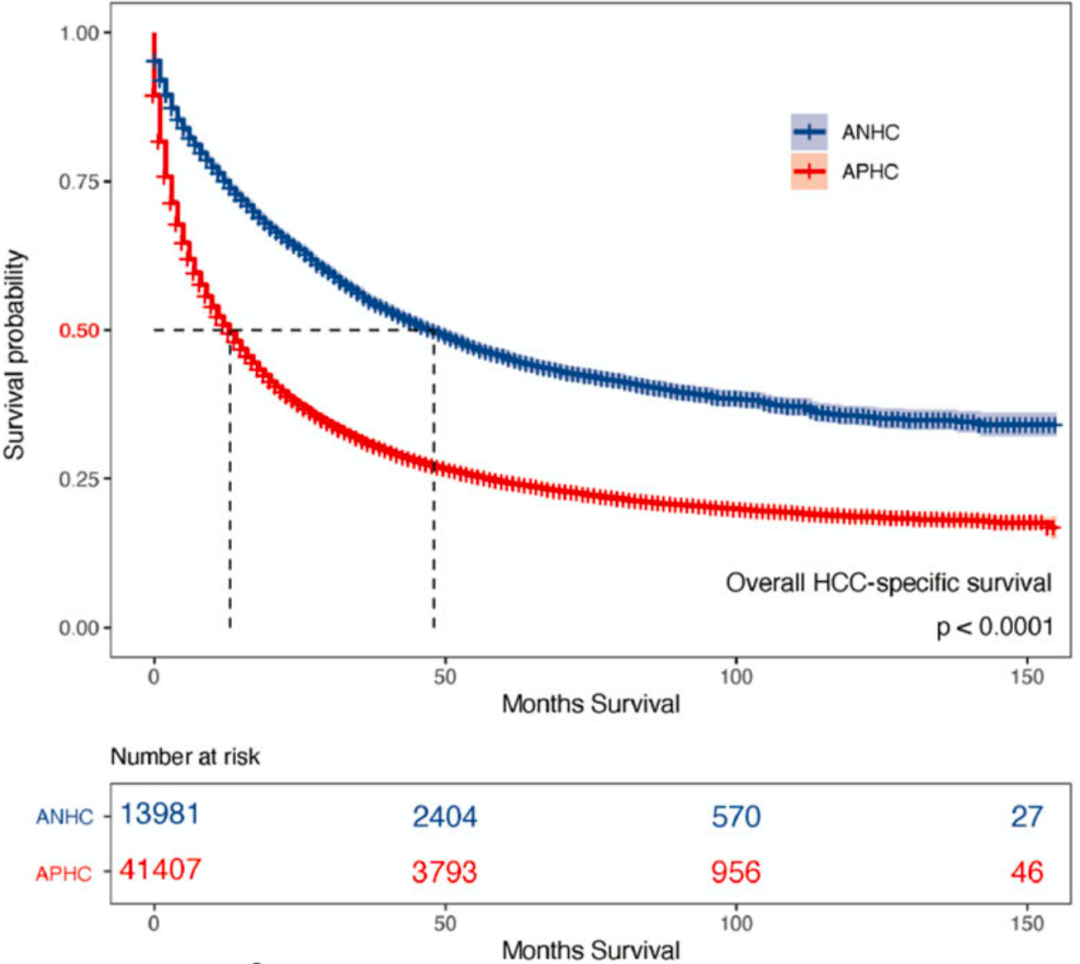
临床回顾性研究数据
从测序结果来看,除了TP53和TTN这两个基因突变在AFP阳性肝癌中更广泛之外,AFP阳性肝癌确实比AFP阴性肝癌在分子层面没有其他的显著特征。在细胞层面的初步研究发现,与AFP阴性肝癌组织和正常组织相比,AFP阳性肝癌组织中有更大比例的细胞处于G2/M状态,也就是说,AFP阳性肝癌的细胞增殖更为活跃。
接下来,王红阳团队深入分析了AFP阳性肝癌和AFP阴性肝癌的免疫特征。
与AFP阴性肝癌相比,AFP阳性肝癌表现出以下特征:许多与抗原呈递有关的基因(如HLA-DRA,CD74)表达上调,干扰素-γ(IFN-γ)响应以及抗原处理和呈递途径富集,主要组织相容性复合体(MHC)I/II类抗原呈递基因高表达。研究人员认为,这些数据表明,在AFP阳性肝癌中T细胞和癌细胞之间的互动更频繁。
单从T细胞的角度来看的话,免疫检查点相关基因PDCD1、CTLA4、HAVCR2、TIGIT和LAG3的表达在AFP阳性肝癌的T细胞上表达水平最高,而效应基因(如IFNG和TNF)在AFP阴性肝癌的T细胞中相对占优势。细胞免疫状态的分析也表明,早期CD8+T细胞和终末耗竭CD8+T细胞主要分布在AFP阳性肝癌中,而处于过渡和效应状态的T细胞主要在AFP阴性肝癌中。
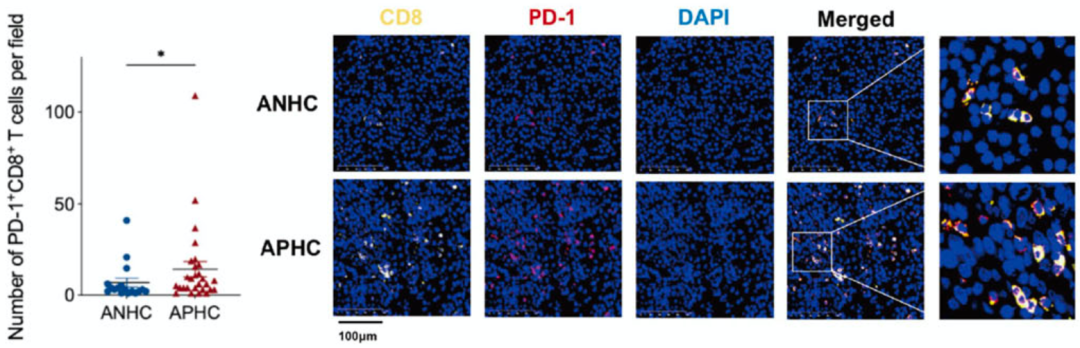
AFP阳性肝癌处于免疫抑制状态
还有一个值得注意的现象是,AFP阳性肝癌组织的肿瘤突变负荷(TMB)也较高。以上的数据表明,AFP阳性肝癌的T细胞倾向于免疫功能失调。这可能正是KEYNOTE-240研究[3]和CheckMate 459研究[4]发现AFP>200ng/mL的肝癌患者总生存率略高的原因。
接下来的一个重要问题是,AFP有没有参与AFP阳性肝癌的免疫逃逸。
王红阳团队发现,敲除肝癌细胞系编码AFP的基因不影响癌细胞的增殖,但是afp基因缺失的癌细胞在免疫健全小鼠身上长出的瘤子确实更小。进一步分析肿瘤微环境之后,答案就出来了:与不能表达AFP的癌细胞形成的肿瘤相比,能表达AFP的肿瘤中耗竭的免疫细胞占比更高,起到免疫抑制作用的调节性T细胞含量也高。
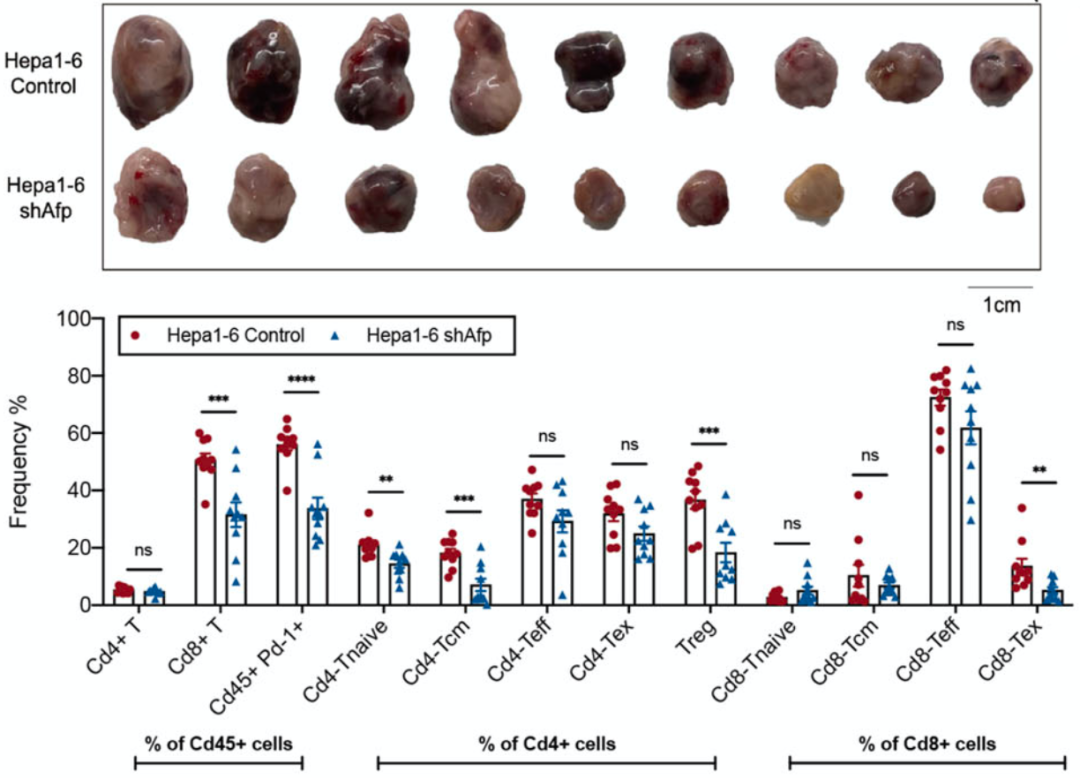
AFP对肿瘤生长和免疫微环境的影响
在此基础上,他们还做了其他的体内和体外实验,得出了一个明确的结论:AFP确实调节了T细胞的功能,方式包括但不限于招募调节性T细胞,促进CD8+T耗竭,进而促进癌细胞的免疫逃逸。
除了T细胞之外,王红阳团队还在AFP阳性肝癌中发现了表达SPP1的TAM富集,而且这个独特的TAM亚群还表现出吞噬功能减弱,但调节血管生成能力和淋巴细胞迁移能力增强的特点。
更重要的是,表达SPP1的TAM亚群可以通过SPP1/CD44通路促进T细胞的耗竭。不过,用抗SPP1抗体或抗CD44抗体阻断这条通路,可以显著抑制肿瘤的生长,而且将这两个抗体分别与PD-1抑制剂连用的话,还可以表现出协同的抗癌作用。
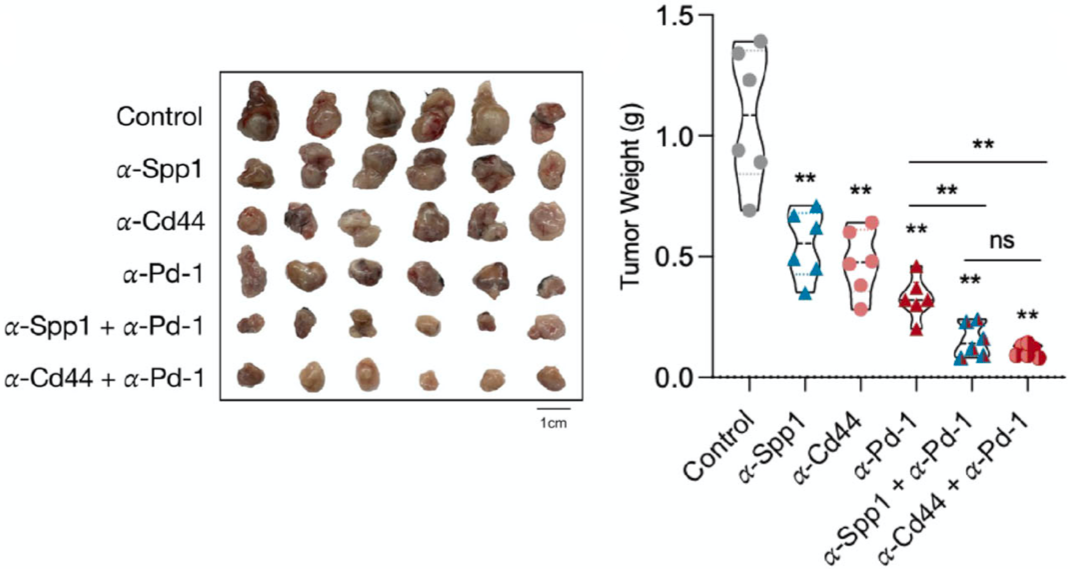
阻断SPP1/CD44通路可以发挥抗癌作用
至于这个TAM亚群为何会高表达SPP1,研究人员也做了探索,发现是肿瘤基质细胞分泌的TGF-β1和IL6,诱导了TAM的SPP1表达。
总的来说,王红阳团队的这项研究成果让我们对AFP阳性肝癌的免疫微环境有了深入的认知,还部分地揭开了AFP阳性肝癌对免疫治疗反应稍好的原因。更重要的是,这个研究找到了新的治疗靶点,以及改善PD-1抑制剂治疗效果的潜在方法。
期待这个研究早日转化到临床,进一步提升肝癌患者的免疫治疗效果。
参考文献:
[1].Bai DS, Zhang C, Chen P, Jin SJ, Jiang GQ. The prognostic correlation of AFP level at diagnosis with pathological grade, progression, and survival of patients with hepatocellular carcinoma. Sci Rep. 2017;7(1):12870. Published 2017 Oct 9. doi:10.1038/s41598-017-12834-1
[2].He H, Chen S, Fan Z, et al. Multi-dimensional single-cell characterization revealed suppressive immune microenvironment in AFP-positive hepatocellular carcinoma. Cell Discov. 2023;9(1):60. doi:10.1038/s41421-023-00563-x
[3].Finn RS, Ryoo BY, Merle P, et al. Pembrolizumab As Second-Line Therapy in Patients With Advanced Hepatocellular Carcinoma in KEYNOTE-240: A Randomized, Double-Blind, Phase III Trial. J Clin Oncol. 2020;38(3):193-202. doi:10.1200/JCO.19.01307
[4].Sangro B, Park J, Finn R, et al. LBA-3 CheckMate 459: long-term (minimum follow-up 33.6 months) survival outcomes with nivolumab versus sorafenib as first-line treatment in patients with advanced hepatocellular carcinoma[J]. Annals of Oncology, 2020, 31: S241-S242.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


