CAR-T细胞疗法研究进展(第48期)
来源:生物谷原创 2025-02-28 09:29
CAR-T (Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良,并使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点!
1.Nature:临床试验表明靶向GD2的CAR-T 细胞有望治疗弥漫性中线胶质瘤
doi:10.1038/s41586-024-08171-9
在一项新的研究中,一种免疫细胞疗法缩小了儿童的脑瘤,恢复了神经功能,而且对于参加斯坦福大学医学院开展的一项临床试验的一名受试者来说,还消除了一种通常被认为无法治愈的脑癌的所有可检测到的痕迹。这项临床试验是称为CAR-T细胞的工程化免疫细胞治疗实体瘤的首批成功案例之一,为罹患致命脑瘤和脊髓肿瘤的儿童带来了希望,其中包括一种称为弥漫性内生性桥脑胶质瘤(diffuse intrinsic pontine glioma, DIPG)的癌症。
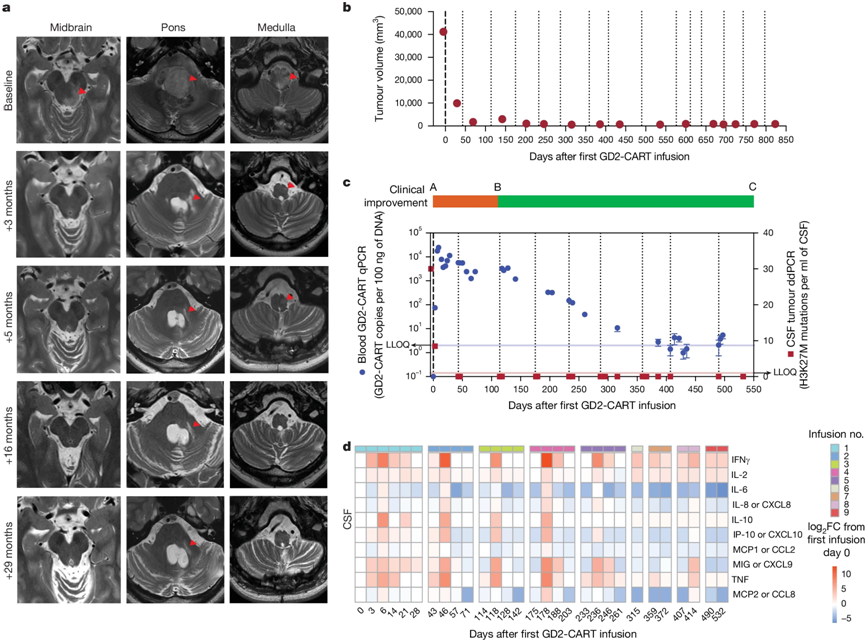
第10号患者的治疗效果及相关结果
2024年10月,这种CAR-T细胞免疫疗法获得了美国食品药品管理局(FDA)颁发的再生医学高级疗法称号,这使得作者能够进入FDA审批程序的快速跟踪版本。
在接受CAR-T细胞治疗的11名参与者中,有9人从中获益。9人在因疾病导致的残疾方面取得了功能性改善。4人的肿瘤体积缩小了一半以上。这四名参与者中有一人获得了完全反应,这意味着他的肿瘤从脑扫描中消失了。虽然现在说他是否已经痊愈还为时过早,但他在确诊四年后依然健康。
论文共同通讯作者兼论文第一作者、斯坦福大学医学院小儿神经肿瘤学教授Michelle Monje博士说,“这是一种普遍致命的疾病,而我们已经找到了一种疗法,可以使肿瘤明显缩小,临床症状明显改善。虽然如何为每位患者优化治疗还有很长的路要走,但有一位患者获得了完全反应,这非常令人兴奋。我希望他已经痊愈了。”
这临床试验中使用的 CAR-T 细胞疗法是斯坦福大学医学院开发的。2018年,Monje团队已发现,DIPG和其他弥漫中线胶质瘤肿瘤细胞会产生大量名为GD2的表面标志物。Mackall团队已设计出靶向GD2的CAR-T细胞,其中GD2也存在于其他一些癌症上。他们发现,在动物模型中,靶向GD2的CAR-T细胞可以根除DIPG肿瘤。
这项新的研究报告了正在进行的一项临床试验的首批13名入选患者的情况,该试验对患有DIPG或脊髓弥漫性中线胶质瘤的患者开放。这些参与者的年龄中位数为15岁,肿瘤确诊时间中位数为参加试验前5个月。其中 10 人患有 DIPG,3 人患有脊髓弥漫性中线胶质瘤。(两名参与者的肿瘤进展太快,以至于在接受CAR-T细胞治疗之前就失去了参加研究的资格)。
2.Nature:重大进展!首批临床试验表明配备IL-15的 GPC3-CAR T 细胞有望更有效治疗实体瘤
doi:10.1038/s41586-024-08261-8
在一项新的研究中,来自贝勒医学院和德克萨斯儿童癌症中心的研究人员报告了针对表达glypican-3 (GPC3)的实体瘤的新型免疫疗法的首批人体1期临床试验结果。他们测试了用白细胞介素-15(IL-15)蛋白增强的嵌合抗原受体(CAR)T细胞。相关研究结果近期发表在Nature期刊上,论文标题为“Interleukin-15-armoured GPC3 CAR T cells for patients with solid cancers”。

GPC3表达评估:免疫组织化学法检测GPC3表达
尽管在一些血液恶性肿瘤中取得了巨大成功,CAR-T细胞对实体瘤患者的疗效有限。临床前研究表明,添加有助于T细胞存活和增殖的IL-15可以提高基于CAR-T细胞的免疫疗法的效果。
在这些临床试验中,这些作者在肝细胞癌(HCC)成人患者(NCT02905188)和表达GPC3的实体瘤(包括HCC)儿童患者(NCT02932956)中测试了共表达IL-15的GPC3特异性CAR-T细胞(下称GPC3-CAR T 细胞)。第一批患者单独接受了 GPC3-CAR T 细胞治疗。他们发现,GPC3-CAR T 细胞是安全的,细胞增殖峰值出现在输注后两周;但没有观察到客观的抗肿瘤反应。
配备IL-15的GPC3-CAR T细胞在第二组患者中进行了评估,这些患者再次包括患有GPC3表达实体瘤的成人(NCT05103631)和儿童(NCT04377932)。参加这些试验的患者的 CAR T 细胞扩增明显增加,33%(4/12)的受试者出现客观抗肿瘤反应,66%(8/12)的受试者病情稳定至少 4 周。接受配备IL-15的GPC3-CAR T细胞治疗的患者发生细胞因子释放综合征的几率较高,不过这种综合征可通过IL-1/IL-6阻断得到控制,或通过激活可诱导的caspase 9安全开关迅速得到改善。
与非应答者相比,应答者的肿瘤浸润GPC3-CAR T细胞显示出 SWI/SNF 表观遗传调节因子的抑制、FOS 和 JUN 家族成员以及 I 型干扰素信号相关基因的上调。这些结果表明,IL-15 能提高患者 GPC3 CAR T 细胞的增殖、瘤内存活率和抗肿瘤活性。
3.Cell Stem Cell:利用脑瘤类器官可以准确地模拟胶质母细胞瘤患者对CAR-T细胞治疗的反应
doi:10.1016/j.stem.2024.11.010
胶质母细胞瘤(GBM)是成年人中最常见、最具侵袭性的癌性脑瘤。GBM患者在确诊后通常只能活12~18个月。尽管进行了数十年的研究,但目前还没有已知的GBM治愈方法,而且批准的治疗方法——如手术、放疗和化疗——在延长预期寿命方面效果有限。
在一项新的研究中,来自宾夕法尼亚大学的研究人员首次使用利用源自GBM患者的肿瘤构建的可在实验室生长的类器官来实时准确地模拟患者对CAR-T细胞治疗的反应。这种类器官对治疗的反应反映了患者大脑中实际肿瘤的反应。也就是说,如果肿瘤衍生的类器官在治疗后缩小,患者的实际肿瘤也会缩小。相关研究结果于2024年12月9日在线发表在Cell Stem Cell期刊上,论文标题为“Patient-derived glioblastoma organoids as real-time avatars for assessing responses to clinical CAR-T cell therapy”。
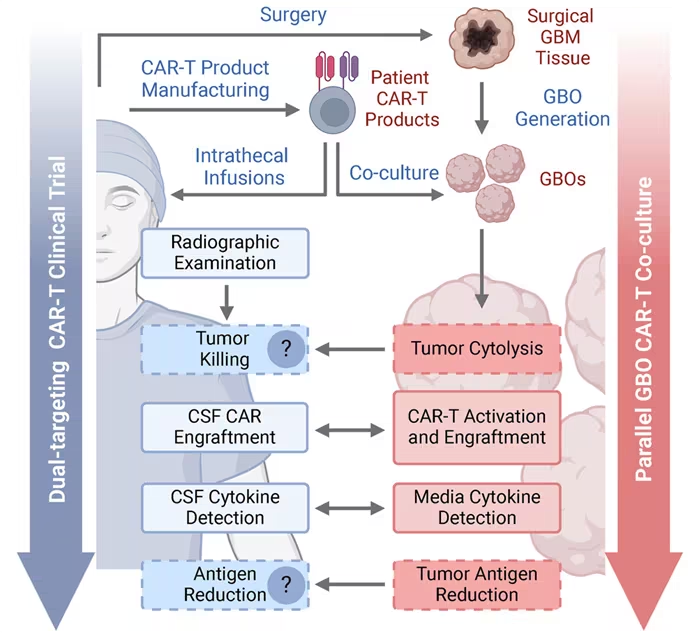
论文共同通讯作者、宾夕法尼亚大学佩雷尔曼医学院神经科学教授Hongjun Song博士说,“很难衡量GBM患者对治疗的反应,因为我们不能定期对大脑进行活检,而且很难基于核磁共振成像(MRI)从治疗相关的炎症中分辨出肿瘤生长。这些类器官非常准确地反映了个体大脑中发生的事情,我们希望它们将来可以用来‘了解’每名患者体内明显复杂的肿瘤,并快速确定哪种疗法对他们的个性化医疗最有效。”
一种称为CAR-T细胞疗法的治疗方法涉及对源自患者的T细胞进行重编程,以发现并摧毁体内特定类型的癌细胞。虽然这种疗法已被美国食品药品管理局(FDA)批准用于对抗几种血液癌症,但是科学家们一直在努力改造免疫细胞,以便成功地寻找和杀死实体瘤,比如GBM。近期的研究已表明,靶向两种脑瘤相关蛋白(而非一种)的CAR-T细胞疗法可能是减少复发性GBM患者实体瘤生长的一种有前景的策略。
论文共同通讯作者、宾夕法尼亚大学佩雷尔曼医学院神经科学教授Guo-li Ming博士说,“GBM治疗如此困难的原因之一是这种肿瘤非常复杂,由几种不同类型的癌细胞、免疫细胞、血管和其他组织组成。通过利用患者实际肿瘤的微小部分而不是一种癌细胞培养出类器官,我们可以反映肿瘤在患者体内的存在方式,以及肿瘤生长的‘微环境’,这是现有的其他GBM模型所无法反映的。”
4.Cell子刊:我国科学家发现米替福新可以让衰竭的CAR-T细胞返老还童,提高它们治疗实体瘤的疗效
doi:10.1016/j.xcrm.2024.101869
为了克服T细胞衰竭,已经提出了各种策略,包括操纵参与T细胞衰竭的基因。TOX、NR4A、BATF、SNX9、CBLB、TGFBR2、ARID1A和REGNASE-1以及ROQUIN-1已被报道可诱导T细胞衰竭。敲除这些基因可以增强T细胞功能。此外,c-JUN、LTBR、IL-7或CCL19已被证明可以减轻CAR-T细胞衰竭,而且它们在多种研究中的过表达可以增强肿瘤消除能力。然而,CAR-T疗法治疗实体瘤的临床疗效仍然有限。此外,尽管ICB在治疗癌症患者方面取得了显著的临床成功,但只有一部分患者在治疗后获得了完全缓解。因此,发现有效的靶点和药物来克服目前治疗的局限性是非常可取的。
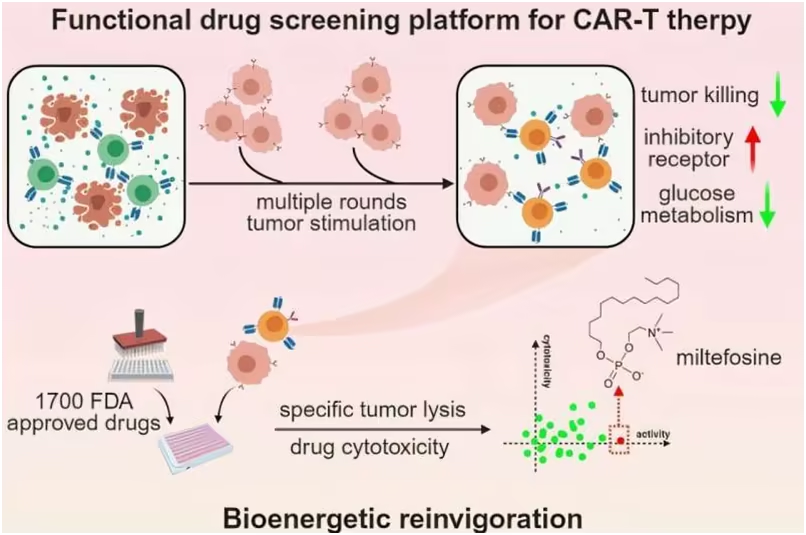
在一项新的研究中,来自中国科学院、中国科学院大学、北京中医药大学、北京干细胞与再生医学研究院、中国人民解放军总医院和深圳大学的研究人员开发出一个使用原代人类T细胞的功能性筛选平台,以鉴定能够使衰竭的T细胞恢复青春并提高其疗效的化合物。相关研究结果发表在2024年12月17日的Cell Reports Medicine期刊上,论文标题为“Miltefosine reinvigorates exhausted T cells by targeting their bioenergetic state”。
利用这个平台,这些作者对美国食品药品管理局(FDA)批准的药物进行了筛选,并发现以前用作治疗利什曼病的抗寄生虫药物的小分子米替福新(miltefosine)可以增强衰竭的CAR-T细胞的疗效。
鉴于PD-1/PD-L1阻断是增强衰竭的T细胞功效的机制和成功策略,这些作者测试了米替福新对功能低下的CAR-T细胞的影响是否依赖于PD-1/PD-L1通路。为了测试这一点,他们构建出敲除PDCD1基因(编码PD-1)的CAR-T细胞,发现米替福新仍然可以增强它们的效应功能。正如预期的那样,由于CAR-T细胞缺乏PD-1表达,抗PD-1抗体无法增强其效应功能。
5.Cell:科学家识别出能帮助癌细胞躲避CAR-T细胞免疫疗法的特殊蛋白
doi:10.1016/j.cell.2024.11.007
嵌合抗原受体(CAR)-T细胞免疫疗法治疗后B细胞恶性肿瘤患者的疾病长期持久缓解仍然不尽如人意,通常是由于患者机体的抗原逃逸所导致的,恶性B细胞转化和致癌生长依赖于有效的ATP合成,尽管其背后的潜在机制研究人员并不清楚。
近日,一篇发表在国际杂志Cell上题为“YTHDF2 promotes ATP synthesis and immune evasion in B cell malignancies”的研究报告中,来自希望之城贝克曼研究所等机构的科学家们通过研究找到了能帮助癌细胞躲避CAR-T细胞疗法的关键罪魁祸首,CAR-T细胞疗法能利用宿主机体的免疫系统寻找并杀死肿瘤细胞,这种疗法通常用于某些类型的白血病和淋巴瘤(诸如血液癌症),然而,一些狡猾的癌细胞已经学会了如何躲避宿主机体的免疫系统避免被破坏,相关研究结果有望帮助开发出更为个体化的疗法来改善癌症患者的生存情况。
文章中,研究者发现,名为YTHDF2的特殊蛋白在促进血液癌症的发生过程中扮演着重要角色,随后他们开发出了能靶向作用并抑制YTHDF2蛋白的新型药用化合物CCI-38,其能减少侵袭性血液癌症的生长,这种方法或能改善成功癌症疗法的可能性。Jianjun Chen博士说道,我们相信,利用CCI-38来靶向作用YTHDF2或能显著提高CAR-T细胞疗法对血液癌症细胞的治疗有效性。
目前治疗血液癌症的挑战之一是一种称之为“抗原逃逸”(antigen escape)的现象,这些疗法的一个关键靶点就是癌细胞上发现的名为CD19的蛋白。然而,在28%-68%的病例中,癌细胞会降低或失去CD19标志物,从而使得疗法的疗效降低,尽管研究人员正在研究能靶向作用多种组分的策略,但仍有近一半的患者会受到这一问题的影响。YTHDF2能开启帮助癌细胞产生稳定能量来源的基因的表达,从而促进细胞生长和扩散的能力,此外,这一蛋白还能通过降低在正常情况下诱发免疫系统检测并攻击癌症的抗原生物标志物的存在,从而帮助癌细胞隐藏自身,最后,在小鼠研究中,过量的YTHDF2就好像狼人(werewolf)的咬伤一样能将血细胞从健康状态转变为癌变状态。
研究者指出,减少对后续疗法的需求或能改善患者的长期生存情况并能减少疾病复发,同时还能减少疗法的副作用和医疗费用。揭示YTHDF2功能背后的生物学基础或能帮助研究人员开发出新型策略来预防肿瘤细胞躲避免疫监视,这或许有望帮助开发新型个体化疗法,从而治疗那些机体血液癌症对初期疗法没有反应或对基于T细胞的免疫疗法有初步反应后复发的癌症患者。
6.Nat Biomed Eng:通过工程化改造T细胞或能帮助癌症患者克服对CAR-T细胞疗法的耐受性
doi:10.1038/s41551-024-0128
对嵌合抗原受体(CAR)T细胞疗法耐药的发生往往通过多种机制,最明显的就是抗原丢失和肿瘤诱导的免疫抑制。近日,一篇发表在国际杂志Nature Biomedical Engineering上题为“Leucine zipper-based immunomagnetic purification of CAR T cells displaying multiple receptors”的研究报告中,来自纪念斯隆凯特琳癌症研究中心等机构的科学家们通过研究开发出了一种新方法,其或能为T细胞添加功能从而帮其克服嵌合抗原受体T细胞疗法(CAR-T细胞疗法)耐药的机制。
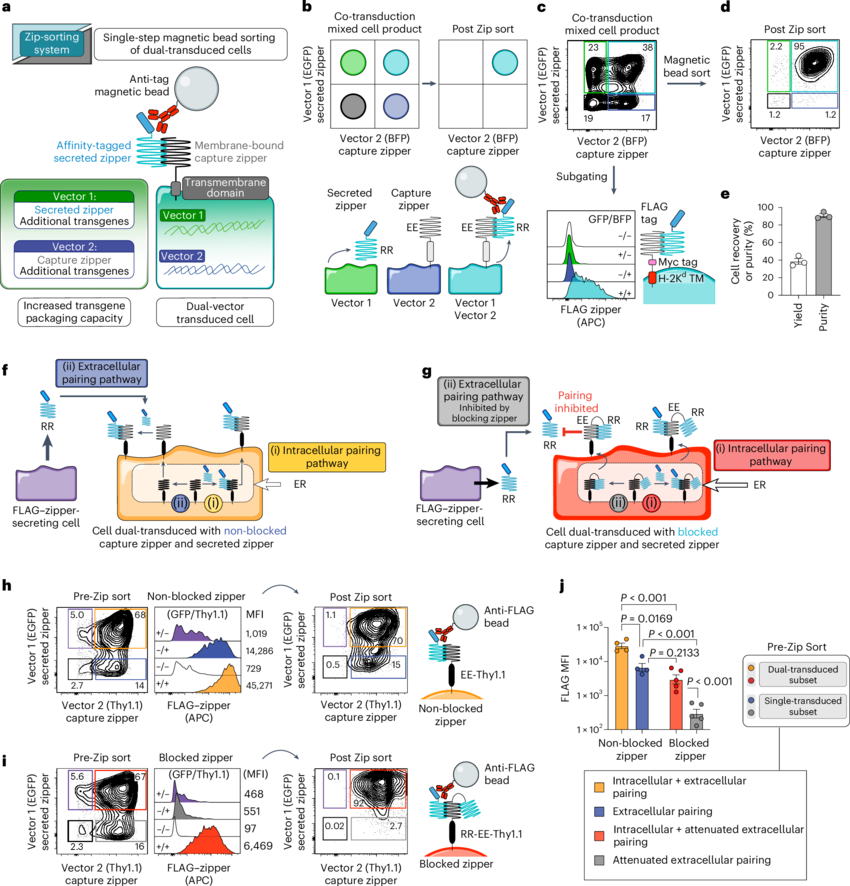
设计出基于亮氨酸拉链的细胞分拣系统
如今,CAR-T细胞疗法已经彻底改变了癌症的治疗,同时为一些血液癌症患者也提供了强有力的治疗选择,然而没有一种疗法是完美的,一些患者对CAR-T细胞疗法产生了一定的耐药性。Scott E. James教授说道,从历史上来看,在这一领域,人们试图克服肿瘤用来躲避免疫疗法攻击的个体化策略,由于当前的载体系统的DNA包装能力有限,因此对T细胞进行工程化修饰从而对多种策略抵抗一直面临着巨大挑战;这项研究中,我们开发出了一种新方法,其能促进对T细胞中的多种特征进行编码,旨在同时克服多种肿瘤逃逸机制。
通过联合研究后,研究人员设计了一种能利用双载体方法来将遗传信息容量加倍的系统,其能同时靶向作用多个抗原;同时这一系统还允许使用开关受体,其能将来自癌细胞的负信号转化为正信号,从而减少T细胞的耗竭,而T细胞耗竭是肿瘤逃逸的另一种机制;这种方法如今已经在高达四种抗原和三种开关受体中进行了相关测试,展现出了更好的抗肿瘤活性,即T细胞增殖地更多且寿命也更长,研究人员将其命名为zip-分拣系统(zip-sorting),其能为构建和比较新型细胞疗法提供一种强大的方法。
7.Nat Commun:科学家开发出工程化改造的CAR-NK细胞,或有望治疗人类急性髓性白血病
doi:10.1038/s41467-024-52388-1
目前人类中存在着多种形式的血液癌症,其统称为白血病(leukemia),急性髓性白血病(AML,acute myeloid leukemia)就是其中一种常见的白血病形式,其主要特征表现为患者机体早期血液细胞前体(即干细胞和由干细胞所发育而成的前体细胞)的降解。尽管这类白血病患者接受了强化的化疗,但也仅有20%-50%的患者在诊断和治疗后能存活5年时间,让患者疾病状况变得更加复杂的是,这些强化疗法会对其机体造血干细胞产生破坏性的影响,因此这往往也与患者机体较为严重的副作用存在关联,这就是为何目前研究人员迫切需要开发新型疗法的原因。
近日,一篇发表在国际杂志Nature Communications上题为“CRISPR/Cas9 editing of NKG2A improves the efficacy of primary CD33-directed chimeric antigen receptor natural killer cells”的研究报告中,来自法兰克福歌德大学等机构的科学家们通过研究对CAR-NK细胞进行成功话改造,或有望作为对抗人类白血病的另一种替代方法。研究者解释道,免疫疗法能利用宿主机体免疫系统的天然力量来对抗恶性白血病细胞,作为这一疗法的一部分,癌细胞能被机体免疫系统中诸如T细胞的杀伤性细胞所识别,比如,T细胞表面有一种锁状结构,而癌细胞表面的相应结构就好像钥匙一样能插入其中,从技术角度来讲,T细胞的锁称之为“抗原受体”,而钥匙则称之为“抗原”。
如果钥匙在锁里,也就是说,如果抗原和抗体结合的话,T细胞就会杀死细胞,如今,研究人员就能定制抗原受体,从而使其能意识到一种特定的肿瘤特征;为此,研究人员从患者血液中纯化出T细胞,并利用遗传工程化技术插入所谓的嵌合抗原受体(CAR),其能结合多种蛋白质的特性,从而以一种特殊的方式使这种攻击针对特定肿瘤进行优化。配备了嵌合抗原受体的T细胞(CAR-T细胞)如今已经成功用于人类白血病的治疗,而另一种目前正在使用的杀伤性细胞就是所谓的自然杀伤性细胞(NK细胞),其并不是通过某些抗原来识别恶性细胞,而是依赖于其它表面的异常,如果再额外添加嵌合抗原受体的话,其就能以两种方式来对抗癌细胞,CAR-NK细胞的另一个优点在于迄今为止其几乎不会在临床研究中引起任何副作用。
8.Nat Immunol:CAR-T记忆细胞或能增强癌症疗法的疗效
doi:10.1038/s41590-024-02034-1
尽管嵌合抗原受体(CAR)T细胞能有效抵御B谱系恶性肿瘤,但CAR后患者疾病复发很常见,且对其它肿瘤的治疗疗效非常有限,这些挑战或能通过合理的操控来控制CAR-T细胞的功能来解决。
近日,一篇发表在国际杂志Nature Immunology上题为“Antigen experience history directs distinct functional states of CD8+ CAR T cells during the antileukemia response”的研究报告中,来自科罗拉多大学安舒茨医学院等机构的科学家们通过研究发现,一些用于抵御癌症和其它疾病的CAR-T细胞或携带着过去与细菌、病毒和其它抗原相遇时的记忆,而这一研究发现或能促使科学家们以更精准且靶向性的方式来制造细胞。
抗原经历史或能指导小鼠机体CAR-T细胞体外功能的多个方面
文章中,研究人员重点研究了CAR-T细胞,其是一种能抵御癌症,尤其是白血病和淋巴瘤的有效疗法,作为一种免疫细胞类型,T细胞能从患者血液中移除,随后进行修饰来靶向作用癌症并被重新输注回患者体内。如今,研究人员发现,其中一些细胞具有长期持久性的记忆,他们发现,即使经过大量改造过程将CAR插入到细胞中,过去与抗原接触过的CAR-T细胞的行为也与从未接触过抗原的细胞不同。
医学博士Terry Fry说道,与大多数药物不同,CAR-T细胞的产品并不统一,我们知道变异会存在,但这种变异的本质或许才刚刚开始被理解;而令人惊讶的是,过去与抗原的相互作用在细胞上或许留下了持久的印记。研究者发现,那些此前有抗原经历的“记忆细胞”或能快速杀死癌细胞但也会很快发生耗竭,且繁殖较慢,这或许就为潜在的复发打开了大门。与此同时,研究人员发现了一些有利的抗病能力,比如先天性细胞强大的扩张和对耗竭的耐受,其也并没有抗原经历;通过对两种细胞类型进行直接地比较后,研究人员就能识别出调节并改善细胞功能的特定基因靶点,他们发现,先天性细胞能通过靶向作用诸如RUNX2等基因来被特异性地增强,而相比记忆细胞而言,这些细胞的寿命也更长且繁殖速度更快。
9.Sciene子刊:免疫突触脂筏的分子动力学影响CAR-T细胞的癌细胞杀伤行为
doi:10.1126/sciadv.adq8114
在一项新的研究中,来自贝勒医学院、德克萨斯儿童癌症中心、休斯顿卫理公会医院和德克萨斯儿童医院的研究人员研究了CAR-T细胞与癌细胞结合的免疫突触的分子动力学如何影响抗癌活性。为此,他们针对两种最常见的CAR-T细胞如何杀死癌症提出了新见解。
相关研究结果发表在2025年1月10日的Science Advances期刊上,论文标题为“Molecular dynamics at immune synapse lipid rafts influence the cytolytic behavior of CAR T cells”。

单个CAR-T细胞杀伤靶细胞的动力学
在这项研究中,这些作者旨在了解具有不同信号结构域的CAR-T细胞如何在分子和细胞水平上发挥作用,为设计以最大限度地提高CAR-T细胞抗肿瘤活性的CAR分子奠定基础。
论文通讯作者、贝勒医学院和德克萨斯儿童癌症中心的儿科血液学和肿瘤学教授Nabil Ahmed博士说,“我们观察了两种不同类型的CAR-T细胞。第一种是CD28.ζ-CART细胞,它们就像短跑运动员,快速有效地杀死癌细胞,但它们的活性是短暂的。第二种是4-1BB.ζ-CART细胞,它们就像马拉松赛跑运动员,在很长一段时间内持续杀死癌细胞。”
10.Cancer Immunol Res:揭秘TBK1分子或许是克服肿瘤对CAR-T细胞疗法耐受性的关键
doi:10.1158/2326-6066.CIR-23-1011
如今,科学家们需要新的治疗性策略来改善嵌合抗原受体(CAR)T细胞治疗人类实体瘤的疗效,多种肿瘤微环境因素被认为能促进实体瘤对CAR-T细胞疗法的耐受性,而且使用临床相关生物样本来识别和分析这些因素的适当模型系统往往是有限的。
近日,一篇发表在国际杂志Cancer Immunology Research上题为“TBK1 Targeting Is Identified as a Therapeutic Strategy to Enhance CAR T-Cell Efficacy Using Patient-Derived Organotypic Tumor Spheroids”的研究报告中,来自麻省总医院等机构的科学家们通过研究识别出了TBK1分子或能作为克服CAR-T细胞疗法耐受性的关键。
那么到底是哪些因素促进了实体瘤对CAR-T细胞疗法的耐受性呢?尽管CAR-T细胞疗法被证明能有效治疗血液癌症患者,但由于包括肿瘤微环境在内的多种因素的影响,其在实体瘤治疗中的疗效却受到了限制;为此,研究人员利用一种特殊的肿瘤3D微流控模型来研究CAR-T细胞疗法耐受性背后的机制,CAR-T细胞被设计能靶向作用B7-H3(实体瘤中的一种常见抗原)。
尽管目前有多重不同的肿瘤3D模型可用,但其能忠实地再现肿瘤微环境中关键因素的能力却非常有限;研究人员利用患者机体衍生的器官型肿瘤球状体(PDOTS,patient-derived organotypic tumor spheroids),其是一种能复制肿瘤微环境关键特征的微生理性3D模型,能促使研究人员分析肿瘤和免疫细胞之间的相互作用。结果发现,当CAR-T细胞与靶向细胞首次相遇后,其表面的抑制性受体的表达就会增加,从而就会引起功能障碍并限制其有效性。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


