张锋的两位学生创立新型基因编辑公司,获超2亿美元融资,开发新一代细胞和基因疗法
来源:生物世界 2023-12-27 10:55
研究团队还在“人源化”的小鼠模型中进行了测试,他们发现,PASTE能够在这些小鼠肝脏中插入基因。这些小鼠的肝脏由大约70%的人类肝细胞组成,而PASTE成功地将新基因整合到2.5%的这些细胞中。
2023年12月8日,美国FDA批准了首个CRISPR基因编辑疗法Casgevy上市,使用CRISPR-Cas9基因编辑技术治疗12岁及以上伴有复发性血管闭塞危象的镰状细胞病(SCD)患者。
几天后的12月12日,一家名为Tome Biosciences的生物技术公司走出隐身模式,宣布完成2.13亿美元融资(A轮+B轮),该公司基于一种名为PASTE的新型基因编辑技术,开发能够在体内纠正基因的治愈性的细胞和基因疗法。

Tome Biosciences由PASTE技术的开发者 Omar Abudayyeh 博士和 Jonathan Gootenberg 博士共同创立,他们二人曾是CRISPR基因编辑先驱张锋教授的研究生,现为麻省理工学院(MIT)的研究员。

Omar Abudayyeh(右) 和 Jonathan Gootenberg(左)
Tome 公司表示,其可编程基因组整合(PGI)平台旨在将任何大小的DNA序列插入到任何编程的基因组位点,PGI平台包括一系列基因组编辑方法,每种方法都代表了对PASTE技术的优化升级。PGI是一个强大且灵活的技术平台,释放了基因组工程的全部潜力,代表了基因组医学的最终章。
Tome 公司在其官网写道,PGI平台克服了当前基因编辑面临的主要局限,具有以下几种优势:
-
以不依赖DNA双链断裂(DSB)的方式高效定向插入DNA片段;
-
插入DNA片段的大小范围为100-10000+碱基;
-
将序列精确插入在编程位点;
-
可同时插入多个序列;
-
可编辑分裂细胞和非分裂细胞;
-
最大限度减少脱靶性;
Tome 公司的初步计划是开发针对单基因肝脏疾病的整合基因疗法和针对自身免疫疾病的细胞疗法。该公司计划在2024年披露更多关于其首批疗法的临床适应症、进展和潜在合作伙伴的细节。
PASTE 技术及原理
2022年11月24日,麻省理工学院的 Omar Abudayyeh、Jonathan Gootenberg 等人在 Nature Biotechnology 期刊发表了题为:Drag-and-drop genome insertion of large sequences without double-strand DNA cleavage using CRISPR-directed integrases 的研究论文【1】。
该研究在CRISPR的基础上开发了一种名为PASTE的新技术,能够以更安全、更有效的方式替换突变基因,可向哺乳动物及人类细胞中定点插入长达36000个碱基的DNA长片段。

在这项研究中,研究团队专注于丝氨酸整合酶,它可以插入大片段DNA序列,最长可达5万个碱基对。这些整合酶的目标是被称为附着位点的特定基因组序列,它起着“着陆垫”的作用。当整合酶在宿主基因组中找到正确的附着位点时,就会与之结合,然后将携带的DNA片段整合进去。
然而,将这些整合酶应用于人类基因治疗很有挑战性,因为它们在基因组上的附着位点很特定,很难对整合酶进行重编程以定位到其他位点。Omar Abudayyeh、Jonathan Gootenberg 团队意识到,CRISPR-Cas9能够靶向特定位点,将其与整合酶结合,有望实现可编程的大片段基因插入。
基于上述想法,研究团队开发了一种名为PASTE(Programmable Addition via Site-specific Targeting Elements)的新工具。该新工具包含Cas9切口酶(只切断DNA一条链,而不造成DNA双链断裂),它在gRNA的引导下切割特定基因组位点,此时Cas9切口酶融合的逆转录酶将整合酶所需的附着位点序列整合进切割位点。通过这种方式,就可以将整合酶所需的附着位点插入基因组中的任何位置,而且这种插入不引起DNA双链断裂,此时,整合酶就可以与附着位点结合,将大片段DNA序列插入。
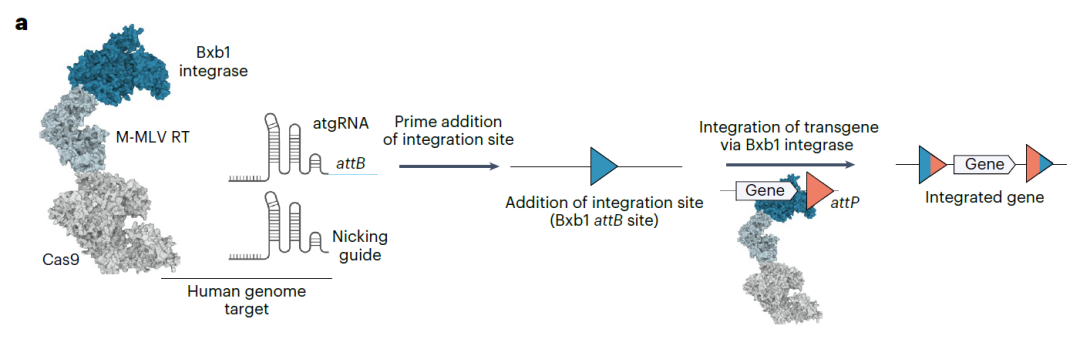
PASTE技术原理
注:Programmable Addition via Site-specific Targeting Elements(基于位点特异性靶向元件的可编程添加),简称PASTE,PASTE这个词本身有粘贴、插入的意思。
Jonathan Gootenberg 表示,这项研究是实现可编程的DNA大片段插入梦想的一大步,通过这一技术可以很容易地根据需要定制附着位点和整合DNA片段。
实现大片段DNA的定点插入
在这项研究中,研究团队使用PASTE技术将DNA片段插入了包括肝细胞、T细胞和淋巴母细胞等人类细胞中,研究团队测试了13个不同的DNA片段,其中包括一些具有治疗意义的基因,能够将它们插入到基因组中的9个不同位点。
在人类细胞中,PASTE将DNA片段成功插入基因组的效率在5%-60%之间,而且很少在插入位点引入不需要的Indel(插入或缺失突变)。Omar Abudayyeh 表示,很少看到Indel,是因为PASTE没有造成DNA双链断裂,因此不必担心染色体重排或染色体缺失等潜在副作用。
研究团队还在“人源化”的小鼠模型中进行了测试,他们发现,PASTE能够在这些小鼠肝脏中插入基因。这些小鼠的肝脏由大约70%的人类肝细胞组成,而PASTE成功地将新基因整合到2.5%的这些细胞中。
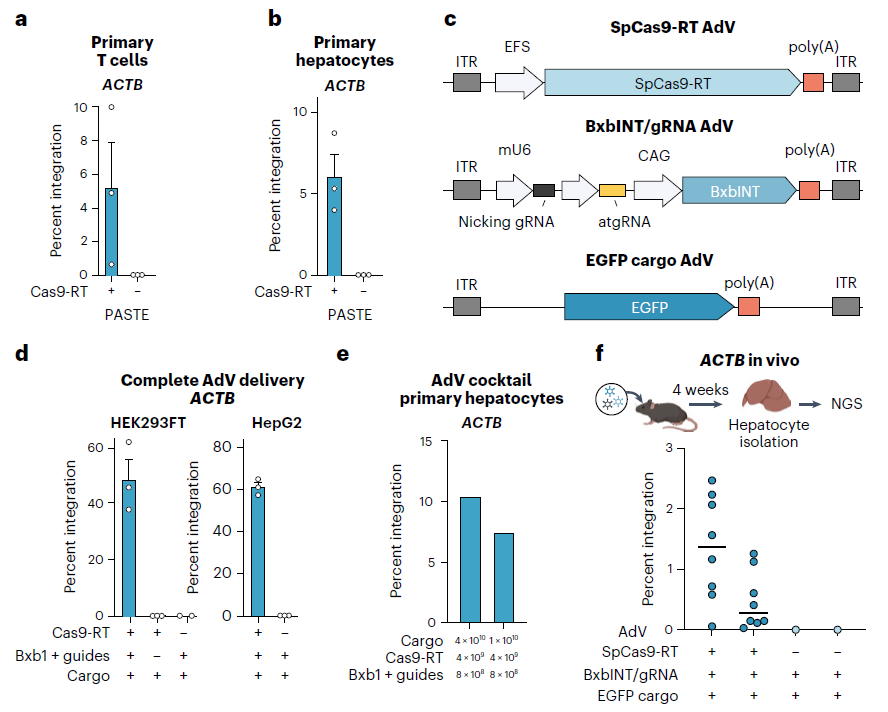
在这项研究中,研究团队最长插入了36000个碱基对的DNA序列,但他们表示还可以更长。人类基因的碱基对从几百个到200多万个不等,但在治疗中只需要使用其中编码蛋白质的序列,也就是外显子序列即可,这大大减少了所需插入的DNA片段的大小。
总的来说,这些研究实现了在分裂和非分裂细胞中的高效、定点的大片段DNA插入,大大扩展了基因编辑的范围,为复杂基因缺陷疾病的治疗提供了新的工具,同时也为CAR-T等细胞疗法提供了新的工具。
PASTE与先导编辑
从上述技术原理来看,PASTE很容易让人想到刘如谦教授团队开发的先导编辑(Prime Editing),在先导编辑系统的Cas9切口酶和逆转录酶的基础上融合了丝氨酸整合酶,相当于使用先导编辑先在基因组中插入丝氨酸整合酶的附着位点,然后通过丝氨酸整合酶来插入大片段DNA。
这也引发了外界对于使用PASTE技术是否需要获得先导编辑技术专利授权的疑问。

Rahul Kakkar 博士
Tome 公司坚称不需要获得先导编辑技术的专利授权,其CEO Rahul Kakkar 博士表示,我认为基于CRISPR的技术、碱基编辑、先导编辑,以及我们的PGI,都有临床开发的空间。我们都为不同的临床适应症、不同的患者人群服务,我希望所有这些公司都能发展好。我不会直接评论他们的知识产权,相信我们拥有非常牢固的知识产权。在这一点上,我们没有寻求,也不打算寻求任何第三方的专利授权许可。
《生物世界》曾采访这篇 Nature Biotechnology 论文的作者姜凯议,他表示,实际上,先导编辑中的Cas9切口酶和逆转录酶不一定非要融合在一起,分开递送也同样可以发挥作用甚至效果更好。团队也已经申请了将Cas9切口酶和逆转录酶分开发挥作用的相关专利。而且,对于大片段DNA插入而言,PASTE要比先导编辑以及后续升级的双先导编辑的效率都要更高。
刘如谦不这么认为

刘如谦教授
位点特异性重组酶已被用于编辑基因组有着几十年历史,包括经典的Cre重组酶、Flp重组酶和Bxb1整合酶等等。重组酶附着位点对于位点特异性重组酶至关重要,人类基因组没有这种可用的、特征明确的重组酶附着位点。在刘如谦团队发明先导编辑技术之前,重组酶附着位点无法被有效地安装在大多数类型的细胞基因组中指定的目标位点。
刘如谦教授表示,我们在2018年开发先导编辑(Prime Editing)时就认识到使用先导编辑将重组酶附着位点安装到基因组DNA的目标位点的有用性。这也是为什么我们2019年在 Nature 发表的先导编辑论文【2】和美国专利都包括了使用先导编辑将位点特异性重组酶附着位点安装到人类细胞基因组DNA中的例子。
刘如谦教授还表示,2021年12月,自己的实验室在 Nature Biotechnology 期刊发表了论文【3】,开发了双先导编辑(TwinPE)技术,并通过将先导编辑与位点特异性丝氨酸重组酶结合使用,将大片段DNA整合到人类细胞基因组的特定位置。此外,自己的实验室还在今年8月31日在 Cell 发表论文,证实了先导编辑可以有效地将重组酶附着位点安装到动物体内的目标基因组位点。
最后,刘如谦表示,经过几个月的实验,我们一致观察到PASTE的编辑整合效率低于简单的将先导编辑和重组酶联合使用。一个可能的原因是:PASTE相当于将先导编辑与重组酶融合成一个蛋白,而Prime Medicine(由刘如谦创立的基因编辑疗法公司)的PASSIGETM(prime-assisted site-specific integrase gene editing)方法通常将它们作为两个单独的蛋白质使用。我们从未观察到将先导编辑器与整合酶进行融合会带来任何好处。
论文链接:
1. https://www.nature.com/articles/s41587-022-01527-4
2. https://www.nature.com/articles/s41586-019-1711-4
3. https://www.nature.com/articles/s41587-021-01133-w
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


