《科学·进展》:中国科学家发现胆固醇竟是PD-L1的“稳定器”,助力癌细胞免疫逃逸!
来源:奇点糕 2022-10-12 17:23
PD-L1具有一种独特的配置来保证其稳定性。依赖于两个关键的CRAC胆固醇基序,PD-L1与胆固醇结合,防止自身被降解。当这两个基序发生突变时,即会破坏PD-L1与胆固醇的结合作用
对于人体来说,胆固醇究竟是友是敌?
一方面,胆固醇是细胞膜的主要成分,与细胞膜的结构完整性、厚度、渗透性和流动性有关,并可以通过影响多种跨膜蛋白(如Na+-K+泵)的结构、功能和动力学来调节细胞功能。同时,胆固醇还是多种激素的前体,在调节细胞功能和信号传导的过程中起关键作用[1,2]。
另一方面,过多的胆固醇长期堆积在动脉中会形成斑块,一旦斑块破裂便会阻塞血液流向心脏和大脑,引发心血管疾病[1]。近年来还有越来越多的研究表示,胆固醇在癌症进展中也发挥着重要作用,癌细胞的快速增殖和侵袭需要高水平的胆固醇,且肿瘤微环境中的高胆固醇水平会影响肿瘤浸润免疫细胞的表型和活性。如果使用他汀类药物降低胆固醇水平,可在多种类型癌症中获益[2]。因此,调节胆固醇水平被认为是抗癌和提高免疫治疗效果的“潜力股”。
如此来看,胆固醇与人体细胞之间的平衡着实是十分微妙。
中国科学院的欧阳波、温茂荣与天津医科大学的王树清等人合作,揭示胆固醇在调节细胞表面PD-L1水平的过程中具有独特作用,为癌症治疗药物的开发提供了新见解。
他们发现,胆固醇可以与PD-L1跨膜结构域上的两个CRAC基序识别并结合,形成“三明治”结构,从而增加PD-L1的稳定性,防止其降解,可能有助于肿瘤细胞逃避免疫监视。研究于近日发表在Science Advances期刊上[2]。

论文首页截图
PD-L1就不用多加介绍了,免疫治疗中的明星靶点,在肿瘤细胞表面高表达。当PD-L1与免疫细胞表面的PD-1识别互作后,则会让免疫细胞对肿瘤细胞“视而不见”,抑制免疫应答反应。PD-L1免疫抑制剂便是通过特异性阻断PD-1/PD-L1的相互作用,来恢复 T 细胞的肿瘤杀伤活性。
PD-L1身上,还有哪些宝藏有待发掘和利用呢?
有研究表明,使用他汀类药物治疗时,细胞表面的PD-L1水平显著降低,说明PD-L1与胆固醇之间可能存在密切关系。另外,已经发现PD-L1的跨膜结构域含有两个经典的CRAC胆固醇结合基序,这样一来,胆固醇直接作用于PD-L1的嫌疑就更大了。不过,胆固醇究竟对PD-L1的稳定性和功能有啥影响,尚未有定论。
在这项研究中,欧阳波等人首先在人结直肠癌细胞系(RKO)中进行免疫荧光染色和共定位分析,发现PD-L1和胆固醇之间具有很强的空间相关性。
随后,研究者们分别用胆固醇、甲基-β-环糊精(MCD)、辛伐他汀处理RKO细胞。其中,MCD和辛伐他汀都有降低胆固醇的效果。
蛋白质印迹分析、共聚焦成像等结果显示,向RKO细胞中添加胆固醇会增加质膜中胆固醇的含量,PD-L1水平显著上调;而添加 MCD 或辛伐他汀的效果则与之相反,胆固醇被去除后,细胞表面的PD-L1水平显著下调,且内源性PD-L1的泛素化修饰增加,可能与其被泛素化降解有关。
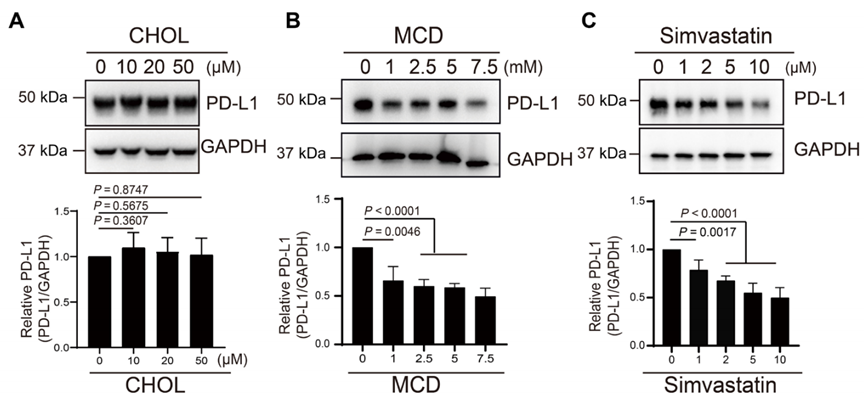
对于PD-L1来说,胆固醇似乎有特别之处
研究者们在人永生化骨髓性白血病细胞系(K562)进一步验证上述结论。这次,他们在K562细胞中加入干扰素-γ(IFN-γ)来刺激其表达PD-L1,导致K562细胞的PD-L1水平上调。结果发现,在这种情况下使用MCD或辛伐他汀来降低胆固醇水平,K562细胞的PD-L1水平依旧显著下调。
这些体外实验表明,在细胞维持PD-L1水平的过程中,胆固醇扮演了至关重要的角色。
利用多功能核磁共振(NMR)等技术,研究者们进一步对PD-L1的跨膜结构域(PD-L1-TC)进行表征,描述其构象,并表明,当PD-L1与两个胆固醇分子结合时可显示出良好稳定性。
具体来看,PD-L1依赖于其跨膜结构域中的2个胆固醇结合基序——CRAC1和CRAC2基序,与胆固醇发生识别和互作。CRAC1 基序中的F257和F259结合位点通过疏水作用与胆固醇相互作用;CRAC2基序中的R260和R262结合位点通过氢键与胆固醇相互作用。在这种情况下,PD-L1被胆固醇包裹成“三明治结构”,从而增加其在细胞膜上的稳定性。
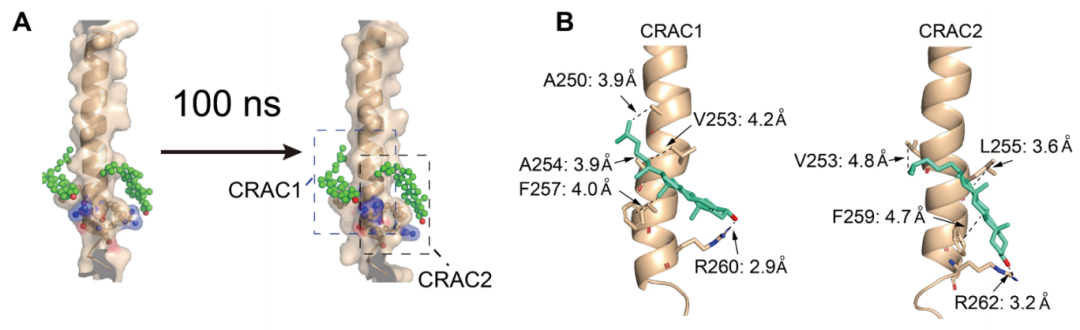
这俩基序长这个样子
最后,研究者们验证表明,PD-L1要是想“傍住”胆固醇来保全自己,依赖于CRAC1和CRAC2这两个基序正常表达。
他们将这两种基序上的胆固醇结合位点特异性敲除,分别生成表达PD-L1F257A、PD-L1F259A、PD-L1R260A和 PD-L1R262A突变体的RKO细胞。结果显示,与表达野生型PD-L1的RKO细胞相比,这四种携带不同结合位点突变的RKO细胞内,PD-L1 mRNA水平相近,但PD-L1蛋白突变体的泛素化水平更高(下图A)、降解速度更快(下图C),且细胞膜表面PD-L1水平更低(下图B)。
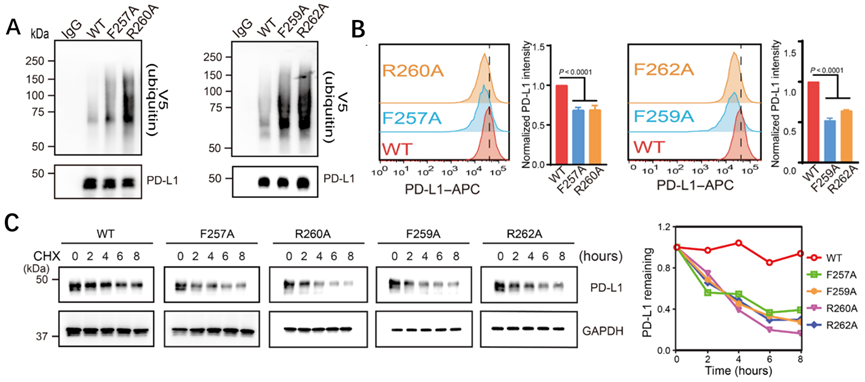
有了CRAC,胆固醇为PD-L1保驾护航,防止被泛素化降解
总的来说,PD-L1具有一种独特的配置来保证其稳定性。依赖于两个关键的CRAC胆固醇基序,PD-L1与胆固醇结合,防止自身被降解。当这两个基序发生突变时,即会破坏PD-L1与胆固醇的结合作用,加剧PD-L1的降解。
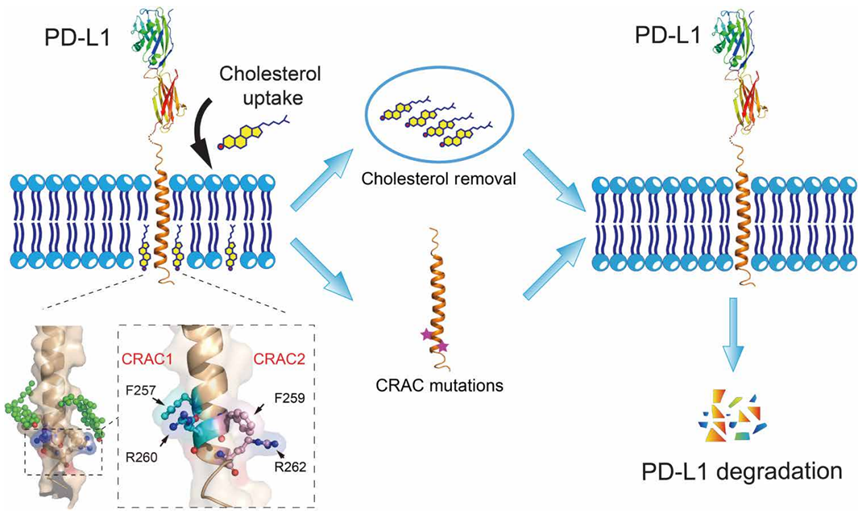
来个简单明了机制图吧
另外,这项研究中再次证实,使用降低胆固醇的药物进行治疗,可以降低肿瘤细胞表面的PD-L1水平。但这与之前的研究结论还是有许多不同之处。
既往研究表明,他汀类药物可通过抑制蛋白激酶B(AKT)和β-连环蛋白介导的信号通路,来降低肿瘤细胞中PD-L1的表达[3]。另外,辛伐他汀可通过抑制长链非编码RNA(SNHG29) 的表达来抑制 PD-L1表达[4]。很明显,两项研究都显示了他汀类药物的间接作用,即调控PD-L1相关因子的活性,进而下调PD-L1水平。
而在这项研究中,欧阳波、王树清、温茂荣等人则是揭示了胆固醇对PD-L1的直接影响,为癌症治疗提供新策略——通过减少或去除胆固醇来降低肿瘤细胞表面的PD-L1水平,以此为原理或可开发用于癌症治疗的小分子抑制剂。
参考文献:
[1]https://www.science.org/doi/10.1126/sciadv.ade5927
[2]https://www.science.org/doi/10.1126/sciadv.abq4722
[3]W. J. Lim, et al, Statins decrease programmed death-ligand 1 (PD-L1) by inhibiting AKT and beta-catenin signaling. Cells10, 2488 (2021).
[4]W. Ni, et al, Targeting cholesterol biosynthesis promotes anti-tumor immunity by inhibiting long noncoding RNA SNHG29-mediated YAP activation. Mol. Ther. 29, 2995–3010 (2021).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


