黑猩猩腺病毒+自扩增mRNA癌症疫苗,在临床试验中延长晚期实体瘤患者总生存期
来源:生物世界 2022-08-19 16:44
随着生物学和医学的发展,人类对癌症以及自身免疫系统的认知愈渐加深,科学家们也意识到免疫系统才是对抗癌症最具杀伤力的武器。基于此,近些年来,癌症免疫疗法逐渐兴起并不断完善。
随着生物学和医学的发展,人类对癌症以及自身免疫系统的认知愈渐加深,科学家们也意识到免疫系统才是对抗癌症最具杀伤力的武器。基于此,近些年来,癌症免疫疗法逐渐兴起并不断完善。
如今,癌症免疫疗法在利用免疫系统靶向和摧毁癌症方面已展现出良好的前景,使突变负担高的癌症患者获益。多项研究表明,靶向肿瘤新抗原的细胞毒性CD8+T细胞对免疫检查点抑制疗法(CPI)的肿瘤控制和清除至关重要。因此,如果能扩大预先存在的肿瘤特异性T细胞的数量,无疑能大大增强了CPI疗法的治疗效果。
2022年8月15日,美国 Gritstone Bio 公司在国际顶尖医学期刊 Nature Medicine 上发表了题为:Individualized, heterologous chimpanzee adenovirus and self-amplifying mRNA neoantigen vaccine for advanced metastatic solid tumors: phase 1 trial interim results 的研究论文。
这项1/2期临床研究(NCT03639714)表明,以个性化、异源黑猩猩腺病毒(ChAd68)和自扩增mRNA(samRNA)为基础的新抗原疫苗,可以诱导强烈、持久且有效的肿瘤新抗原特异性CD4+和CD8+T细胞应答,增强免疫检查点抑制剂的疗效,在晚期转移性实体瘤患者的治疗中表现优异。目前,该临床试验已经推进到2/3期。

在过去,许多因素导致癌症疫苗难以达到预期效果,例如自身抗原免疫原性差,晚期癌症患者的免疫力下降以及肿瘤免疫抑制环境等等。因此,以多肽为基础的癌症疫苗迄今为止未能在大多数患者中持续诱导强大的肿瘤新抗原特异性CD8 T细胞应答。
这些失败的例子提示我们,,一种成功的癌症疫苗应该具有以下特点:
1)靶向肿瘤特异性新抗原;
2)使用高度免疫原性疫苗平台;
3)扩大和启动T细胞;
4)与免疫检查点抑制剂治疗结合;
5)产生长期记忆反应,以确保持续的肿瘤控制,以持久的临床效益。
值得注意的是,有研究表明,以病毒载体为基础的疫苗平台(如重组腺病毒)可以启动强大的T细胞反应,并且可以通过使用非人类腺病毒,如黑猩猩腺病毒(ChAd),来规避因先前感染人类腺病毒而导致预先存在的免疫反应。此外,mRNA疫苗已经在一系列癌症和传染病中得到验证,而自扩增mRNA(samRNA)载体由于其表达高而持久抗原水平的能力而受到特别的关注。
在这项最新研究中,研究团队以个性化、异源黑猩猩腺病毒(ChAd68)和委内瑞拉马脑炎病毒samRNA载体为基础的新抗原疫苗作为主要研究端点,评估其安全性和耐受性等指标。
研究对象为非人灵长类动物,以及联合纳武单抗(Nivolumab,抗PD-1单抗)和伊匹单抗(Ipilimumab,抗CTLA-4单抗)的晚期转移性实体瘤患者。
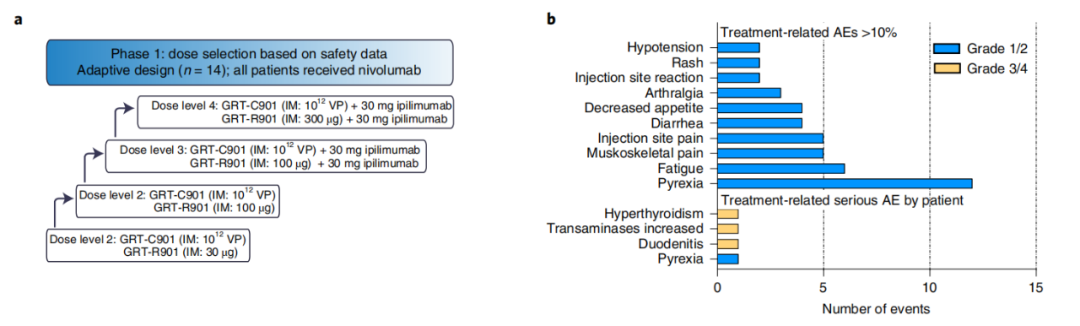
1期研究的示意图
在非人灵长类动物(NHP)实验中,研究团队评估了针对猿类免疫缺陷病毒(SIV)模型抗原的免疫应答的效力和寿命,以及皮下注射抗CTLA-4单抗的影响。他们发现,异源疫苗接种可在NHP中诱导广泛、持久的CD8+T细胞应答,这些应答可长期检测到,并可在2年后仍持续提高。
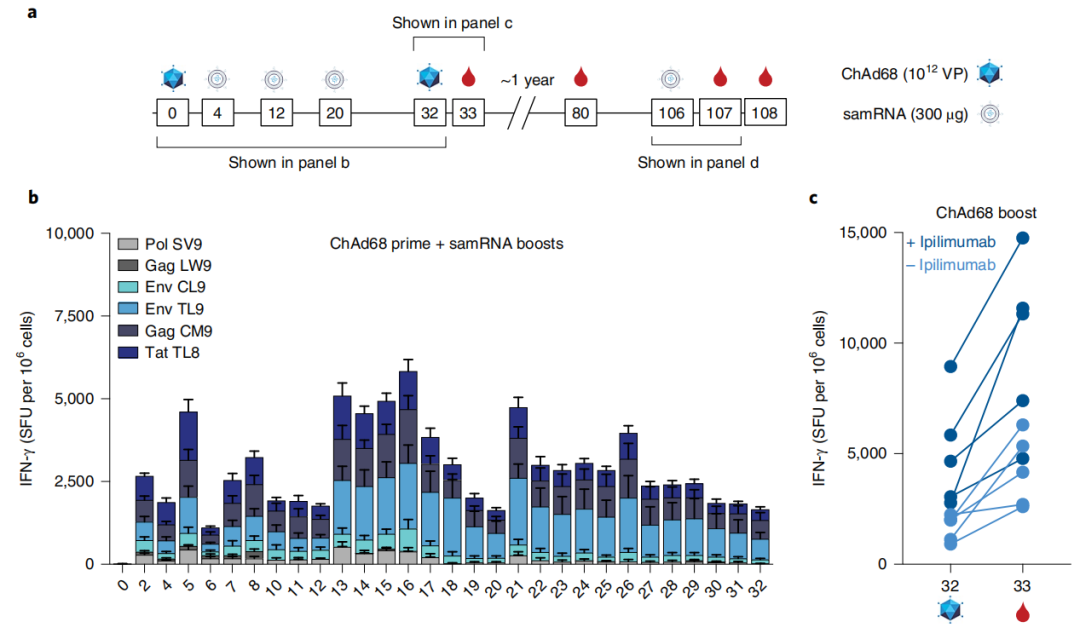
新型疫苗可诱导NHPs中广泛、持久的CD8+T细胞应答
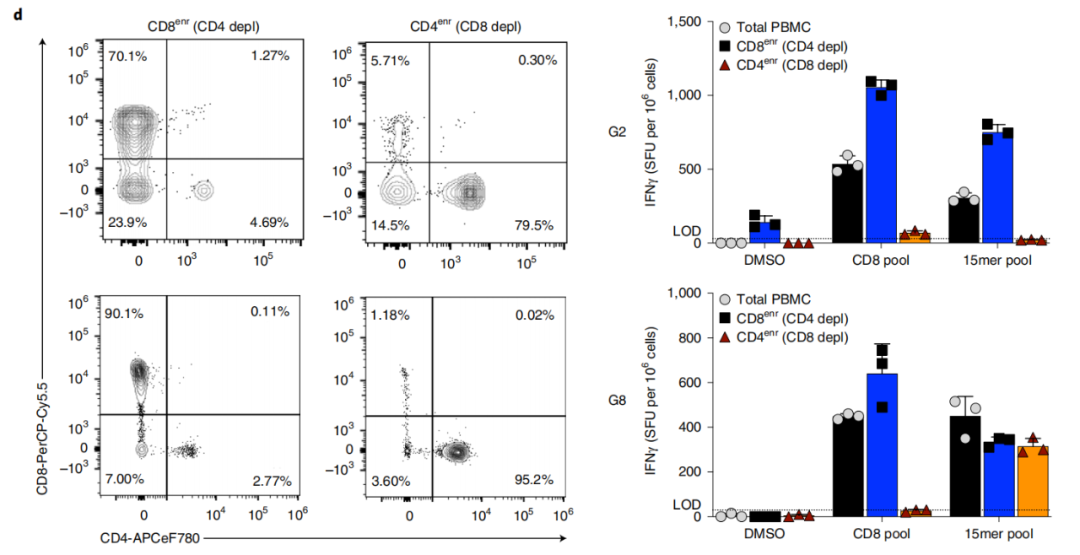
新型疫苗可在晚期转移性实体瘤患者中诱导CD8+T细胞反应
1期临床试验的主要终点是安全性和耐受性,以及确定2期临床试验的推荐剂量。试验结果表明,这一个性化疫苗方案是安全的,耐受性良好,没有剂量限制毒性。治疗相关不良事件(TRAEs)超过10%,包括发热、疲劳、肌肉骨骼和注射部位疼痛和腹泻。严重的TRAE包括发热、十二指肠炎、转氨酶升高和甲状腺功能亢进。推荐的2期临床试验剂量为10^12个病毒颗粒的ChAd68和30µg的samRNA。
1期临床试验的次要终点包括免疫原性、制造可行性和患者的总生存期(OS)。试验结果表明,该疫苗的生产是可行的,并且该疫苗可以诱导持久的新抗原特异性CD8 T细胞应答。一些微卫星稳定型结直肠癌(MSS-CRC)患者的总生存期得到改善。此外,探索性生物标志物分析显示,总生存期延长的患者循环肿瘤DNA(ctDNA)降低。
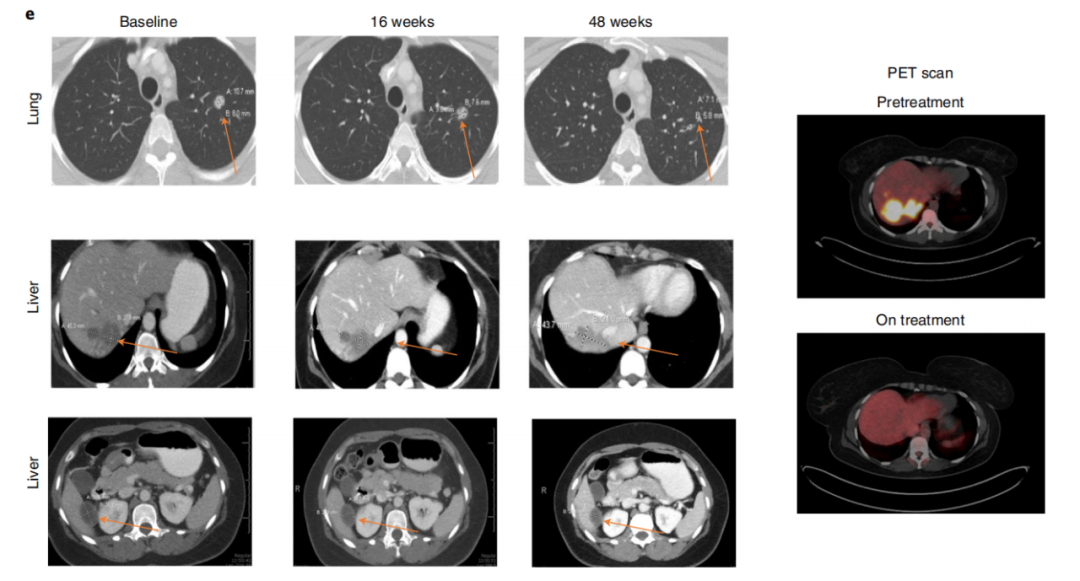
接种新型疫苗改善MSS-CRC患者的总生存期
总而言之,这项临床试验证实,个性化、异源黑猩猩腺病毒(ChAd68)和自扩增mRNA(samRNA)为基础的肿瘤新抗原疫苗的安全性和耐受性良好,并可以诱导持久的肿瘤新抗原特异性CD8 T细胞应答,增强晚期转移性实体瘤患者的免疫检查点抑制剂疗效。这一成果为提高癌症疫苗的有效性指明了前进方向。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


