Nature 重磅突破!铁死亡疗法让癌细胞“引火自焚”,耐药难题迎转机
来源:生物谷原创 2025-11-11 11:49
来自纽约大学Grossman医学院等机构的科学家们通过研究发现,一种实验性药物或能阻断关键蛋白的功能从而诱发肺癌细胞自杀。
肺癌常年稳居全球癌症死亡率榜首,其中,肺腺癌作为非吸烟者中最常见的肺癌类型,约占全部病例的40%。尽管靶向治疗和免疫疗法不断进步,但耐药和复发仍是悬在患者头上的“一把剑”,传统疗法难以攻克的顽固肿瘤,有没有可能被 “诱导自杀”?
近年来,一个名为“铁死亡”的概念在癌症研究领域悄然走红,这是一种由铁依赖的脂质过氧化驱动的细胞死亡方式,犹如在细胞内部点燃一场“氧化火灾”;而癌细胞为了活命也进化出了一套“灭火系统”。如今,科学家们正试图拆掉这个系统让癌细胞“引火自焚”。
一篇发表在国际杂志Nature上题为“Thales Papagiannakopoulos, Targeting FSP1 triggers ferroptosis in lung cancer”的研究报告中,来自纽约大学Grossman医学院等机构的科学家们通过研究发现,一种实验性药物或能阻断关键蛋白的功能从而诱发肺癌细胞自杀。
铁死亡,顾名思义,是一种与铁密切相关的细胞死亡方式,当细胞内的铁离子积累过多就会催化脂质发生过氧化反应并产生大量活性氧,最终导致细胞膜破裂、细胞崩溃。这本是机体清除异常细胞的天然机制,但狡猾的癌细胞却发展出两套关键的“防火墙”: GPX4和FSP1。
其中,GPX4通过催化脂质过氧化物还原发挥作用,而FSP1则通过还原辅酶 Q₁₀(一种强效脂质自由基捕获抗氧化剂)抑制脂质过氧化,两者分工协作守护癌细胞存活。那么,拆掉这些 “防火墙”,癌细胞会不会真的 “自取灭亡”?
为解答这个问题,研究团队利用 KRAS 驱动的肺腺癌基因工程小鼠模型、人类肺癌细胞系及患者来源异种移植(PDX)模型,开展了多维度实验:通过 CRISPR-Cas9 技术特异性敲除肺腺癌细胞中的FSP1基因,观察肿瘤生长变化;使用首个具有体内活性的FSP1抑制剂 icFSP1 治疗荷瘤小鼠,评估抑瘤效果和生存期;结合脂质组学、生存期统计、人类癌症数据库分析,全面验证FSP1的靶点价值。
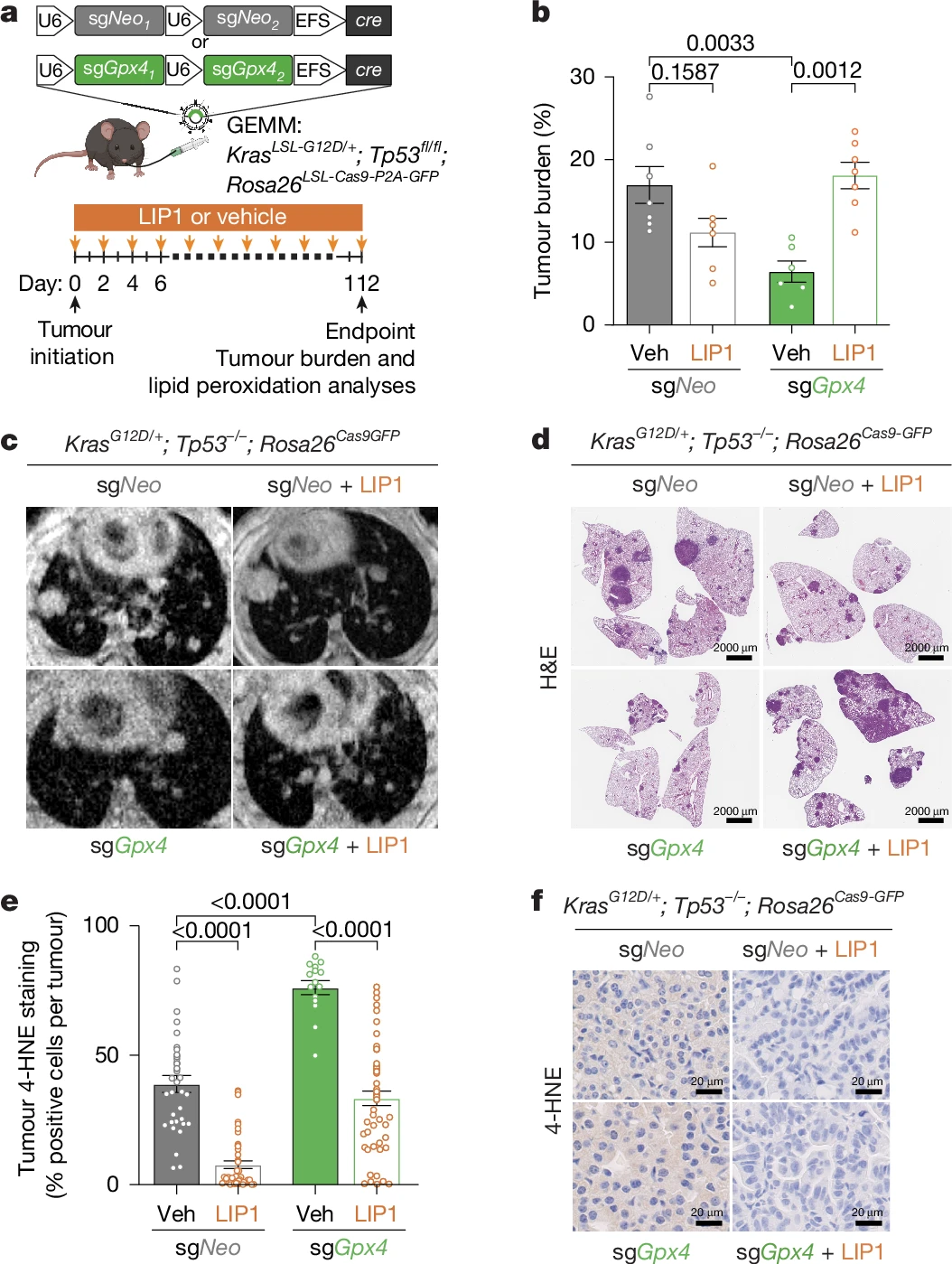
Gpx4缺失会诱发肺部肿瘤发生铁死亡
参考文献:
Wu, K., Vaughan, A.J., Bossowski, J.P. et al. Targeting FSP1 triggers ferroptosis in lung cancer. Nature (2025). doi:10.1038/s41586-025-09710-8
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


