Cell Stem Cell:石莉红/刘伟丽/武鹏/陈照立/朱平团队揭示高原红细胞增多症发病机制,并提出潜在治疗方法
来源:生物世界 2025-04-16 09:53
这项研究对人类适应极端环境具有重要意义,不仅为高原低氧环境的生存挑战提供了解决策略,也为理解机体在太空探索、深海作业、高寒高热等极端环境的生理适应机制提供了重要启示。
缺氧会给生物体带来显著的压力,甚至导致组织损伤;然而,缺氧适应和不适应的细胞及分子机制仍不为人知。
高原红细胞增多症(HAPC)是由于长时间在高海拔地区对低氧环境的适应不足而导致的红细胞过度增殖,是慢性高原反应最常见的临床类型,表现为头痛、眩晕、疲劳、呼吸困难、紫绀等症状。
2025 年 4 月 11 日,中国医学科学院血液病医院(中国医学科学院血液学研究所)石莉红、武鹏、朱平团队联合军事医学研究院陈照立、刘伟丽团队,在 Cell Stem Cell 期刊发表了题为:An erythroid-biased FOShi hematopoietic multipotent progenitor subpopulation contributes to adaptation to chronic hypoxia 的研究论文。
该研究首次发现,骨髓中一个具有红系分化倾向的 FOShi 多能祖细胞(FOShi MPP)亚群,在慢性低氧环境下显著扩增,并揭示该亚群主要通过改变红系偏好基因的表观遗传修饰促进机体对高原缺氧的适应。此外,该研究还进一步提出,使用抗 CD47 单抗和/或干扰素 α(IFN-α)治疗,是高原红细胞增多症(HAPC)的一种有潜力的治疗方法。

在这项最新研究中,研究团队对模拟长期高海拔低氧暴露的高原红细胞增多症(HAPC)小鼠模型中的造血干细胞/祖细胞(HSPC)以及红系细胞进行了单细胞 RNA 测序分析。从中发现了一种独特的具有红系分化倾向的高表达 Fos 基因的多能祖细胞亚群——FOShi MPP,其特征在于对干扰素(IFN)信号的独特反应性,并且在低氧条件下会扩增。
研究团队进一步发现,FOShi MPP 亚群在二次低氧暴露时细胞增殖更快,且红系分化能力更强。从机制上来看,初次低氧暴露后,该细胞亚群的红系基因维持低甲基化水平,形成类似免疫记忆的“表观印记”,从而在二次挑战中实现快速响应。这表明了造血干细胞/祖细胞(HSPC)具有记忆功能,从而能够更快地适应环境。
此外,该研究还发现,HAPC 小鼠的红细胞具有活跃的代谢和自噬活性,并且 CD47 表达丰富,这可防止红细胞被吞噬。CD47 是一种别吃我(Don't eat me)信号,能够防止细胞被巨噬细胞吞噬。
最后,研究团队证实,使用单克隆抗体阻断 CD47,和/或使用干扰素 α(IFN-α)抑制FOShi MPP 的红系分化,减轻了 HAPC 小鼠的红细胞增多症,这些方法或可作为治疗 HAPC 的有前景的策略。
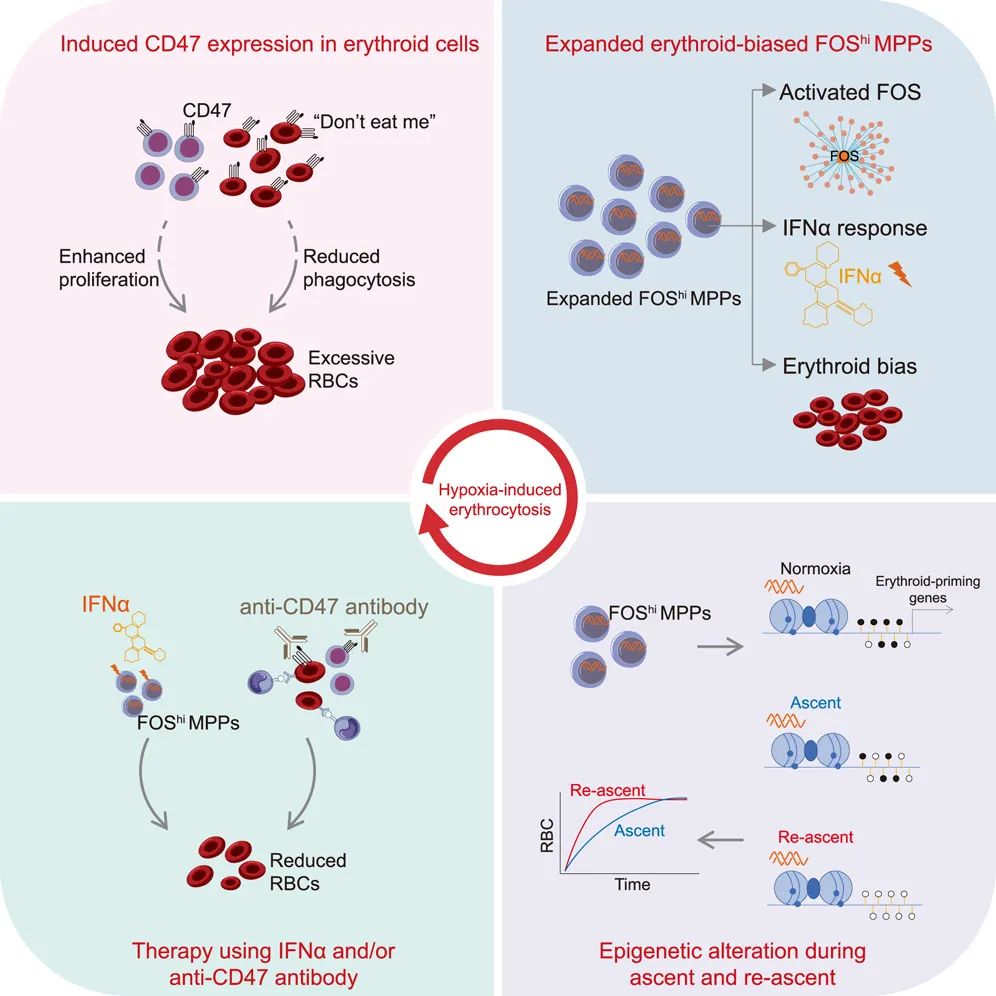
总的来说,这项研究系统解析了高原低氧适应中造血系统的多层次调控机制,实现了理论突破:发现造血系统低氧记忆功能,揭示 FOShi MPP 亚群作为红系分化储备库的功能,阐明表观遗传记忆在高原适应中的重要作用。该研究还具有转化价值,提出靶向 CD47 的抗体和 IFNα 治疗,分别针对成熟红细胞和造血祖细胞的扩增,这种“斩草除根”的潜在策略,为治疗HAPC提供了原创性方案。
此外,这项研究对人类适应极端环境具有重要意义,不仅为高原低氧环境的生存挑战提供了解决策略,也为理解机体在太空探索、深海作业、高寒高热等极端环境的生理适应机制提供了重要启示。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


