Cancer letter:小泛素样修饰物(SUMOs)修饰蛋白在前列腺癌中的多重作用
来源:本站原创 2021-09-23 10:44
小泛素样修饰物(SUMOs)修饰蛋白在前列腺癌(PCa)的发生发展中起着双重作用。SUMO偶联周期的任何中间环节出错,都可能丧失致瘤潜能和抗癌作用之间的平衡。
小泛素样修饰物(SUMOs)修饰蛋白在前列腺癌(PCa)的发生发展中起着双重作用。SUMO偶联周期的任何中间环节出错,都可能丧失致瘤潜能和抗癌作用之间的平衡。雄激素受体和癌蛋白上的失调的sumo化也参与了这一病理过程,如STAT3/NF-κB和肿瘤抑制因子如PTEN和p53。在这里,作者概述了SUMOylation在PCa中的最新发展和发现,并概述了其在PCa肿瘤发生/促进和抑制中的多种作用,同时阐明了其作为PCa治疗靶点的潜力。
图片来源:https://doi.org/10.1016/j.canlet.2021.08.034
据估计,人类大约有4000个蛋白质被小的泛素样修饰物(SUMOs)共价和可逆地修饰,以翻译后修饰(PTM)的方式特异功能。SUMOylation通常发生在底物蛋白上的共识基序在ΨKXE-binding口袋(Ψ代表一个大的疏水氨基酸,X代表任何氨基酸)。然而,仍然有大量的靶向蛋白(近40%)可以在没有ΨKXE的情况下被SUMOylated。sumo化通过改变其活性、定位、稳定性以及与蛋白质/DNA/RNA的相互作用来改变其靶标的性质。在一定程度上,sumo化作用可以对抗这两个PTM途径所针对的相同赖氨酸残基的泛素化。
SUMO化机制由SUMO家族蛋白、SUMO E1激活酶、E2结合酶、E3连接酶和SUMO蛋白酶组成。通常,SUMOylation发生在一个三步酶途径:激活,结合和连接。UBC9是一种SUMO
e2结合酶,它与E3连接酶结合,催化SUMO末端甘氨酸和底物蛋白赖氨酸侧链之间的异肽键。SUMO1可以作为一个单体分子附着在单个或多个赖氨酸位点上;而SUMO2/3形成聚合SUMO链,称为聚SUMO化修饰。RNF4 (RING-type ubiquitin ligase 4)是一种雄激素受体(AR)相互作用蛋白,是哺乳动物多聚sumo靶向的泛素E3连接酶。
SUMO化是一个可逆的过程,用于回收SUMO分子。去sumo化涉及到异肽键的断裂,然后由SENPs从底物中去除sumo,这涉及到前sumo的成熟。迄今为止,哺乳动物中有6个SENPs被命名为SENP1 3和SENP5 7。此外,还报道了第二类SUMO蛋白酶,包括DESI1、DESI2和USPL1it。deSUMOylation对生理稳定状态至关重要,它可以释放SUMOs,使它们有可能参与一个新的循环。
SUMOylation和deSUMOylation在微调各种细胞功能和肿瘤病理过程中的重要作用已逐渐被发现,这与SUMO机械成分的异常表达以及肿瘤蛋白和肿瘤抑制子SUMOylation介导的功能有关。巯基化在某些癌症中不受控制。高水平的sumo - activated enzyme subunit 2 (SAE2)在小细胞肺癌中促进恶性肿瘤的发生,而乳腺癌患者较好的生存率与SAE1和SAE2的低表达有关,这驱动了Myc的合成致死率。当涉及到sumo结合酶和连接酶时,UBC9、PIAS1/3/4或RanBP2表达紊乱与前列腺、结肠、肺、乳腺、卵巢、脑、胰腺肿瘤、白血病和多发性骨髓瘤的风险密切相关。
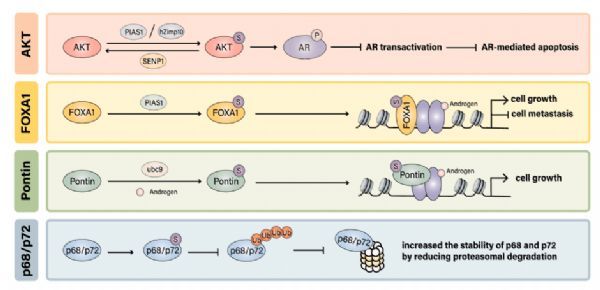
AR信号通路中几个辅助因子的sumo化。
图片来源:https://doi.org/10.1016/j.canlet.2021.08.034
SUMOylation和deSUMOylation之间的平衡被认为是癌症开始和进展的关键因素。SUMOylation 对底物的双重相反作用扰乱了正常的细胞进程,因此,在癌症的促进或抑制中起着至关重要的作用。一方面,SUMOylation主要是发挥致癌作用,另一方面,SUMOylation对肿瘤的抑制作用确实存在,但仅占全部功能的一小部分,还需要进一步的研究。目前对现有针对PCa的SUMOylation疗法的认识尚不完全,因此,应该评估更多的候选化学药物是否对PCa实现治疗效果。综上所述,了解SUMOylation的作用机制可能有助于找到一种新的、更有效的癌症治疗方法,同时也为开发治疗PCa的新药提供基础。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。