补体药物热潮汹涌
来源:医药魔方 2025-04-11 12:04
从偶然发现到全面发展,补体走过了百余年的漫长历程。如今,补体药物已形成多层次技术矩阵,涵盖单抗、小分子抑制剂、环肽、核酸适配体等多种形式,呈现出百花齐放的态势。
补体赛道已在悄然间变得火热。
医药魔方数据库显示,从2023年到2024年,全球有8款补体药物接连获批上市,占到现有补体药物总数的62%。
补体药物研发如火如荼,其商业价值也在持续兑现,2024年全球补体药物市场规模已扩张至81.83亿美元。在未来可预见的高增长态势下,这一数字突破百亿美元不在话下。
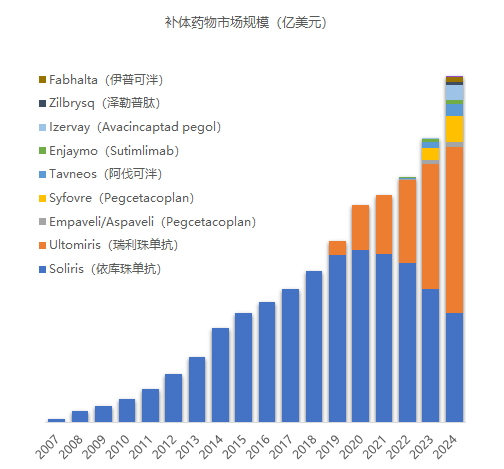
注:因Veopoz(Pozelimab)和Voydeya(Danicopan)未披露销售额,Gohibic(vilobelimab)为2025年上市产品,Piasky(可伐利单抗)销售额可忽略不计(0.18亿美元),图中未显示以上产品
适应症从罕见病向常见病逐步拓展是补体药物市场规模不断扩张的源动力,并且这一趟应用探索之旅还在开辟新的分支。近期,诺华的补体因子B(CFB)抑制剂伊普可泮在中美获批C3肾小球病(C3G)适应症,这是该药物继IgA肾病后在肾病治疗领域拿下的第2项适应症,也是补体药物解锁的第11块疾病拼图。
伊普可泮展现出的巨大潜力也吸引了众多药企纷纷进入CFB赛道,Sefaxersen(罗氏)、HRS-5965(恒瑞医药)、HSK39297(海思科)和MY008211A(朗来科技)四款药物已追赶至伊普可泮身后,准备争夺前三席位。
从罕见病到常见病,补体系统的成药和开疆拓土之旅,正是一段制药界“厚积薄发”的故事。
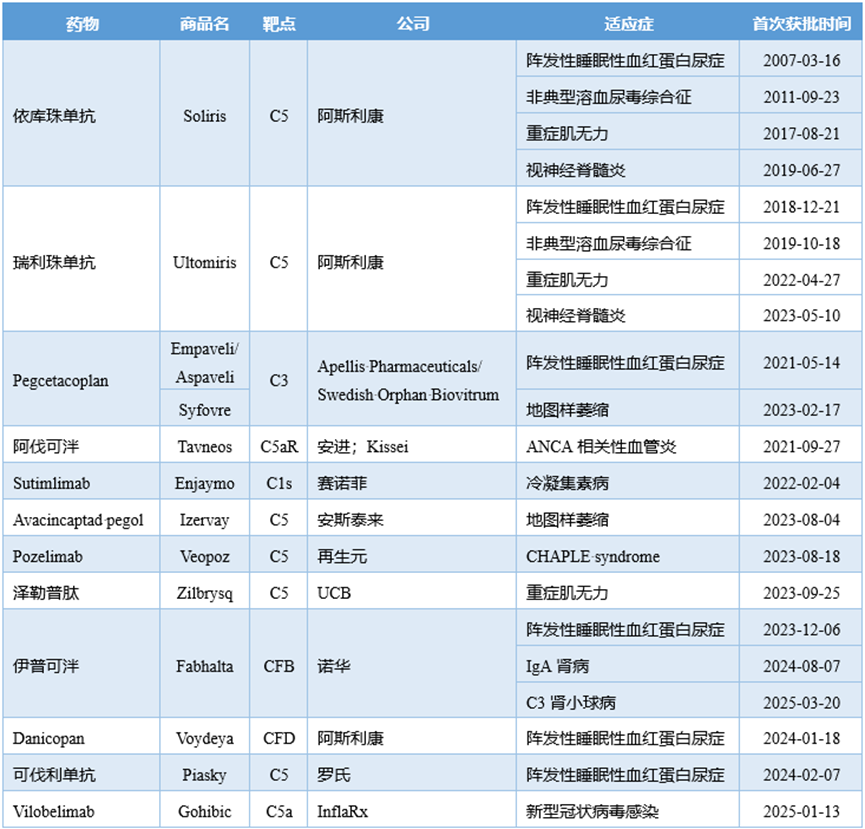
已获批上市的补体药物
缘起:诺奖成果打开免疫学新大门
补体(complement)的发现源于一场偶然。1895年,比利时免疫学家Jules Bordet在一次实验中发现,血清中存在一种能够辅助抗体杀伤霍乱弧菌(Vibrio cholerae)的热不稳定因子[1],后来这种因子被命名为“补体”。这一发现为Jules Bordet赢得了1919年诺贝尔生理学或医学奖的殊荣,也打开了免疫学研究的新维度。
在Bordet的开创性工作之后,科学家们陆续发现了30余种补体成分,并逐步揭示了补体系统的级联反应机制。简而言之,补体主要通过经典途径、甘露聚糖结合凝集素(MBL)途径和旁路途径激活,形成膜攻击复合物(MAC),进而介导免疫反应的发生,从而清除病原体。
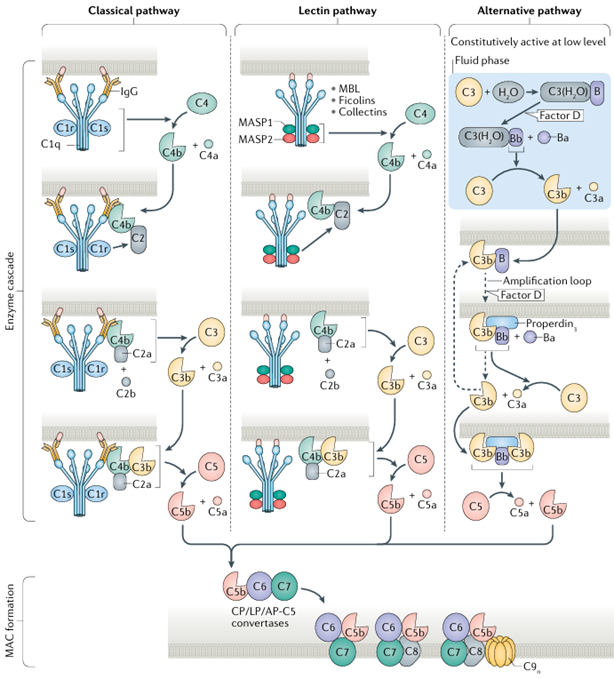
补体激活的主要途径[2]
到目前为止,补体C1、C3和C5是被研究得最为深入的补体成分。C1作为经典途径的启动者,不仅连接先天免疫和适应性免疫,还参与细胞分化、粘附和清除凋亡细胞等多种生理过程。C3是人体中含量最为丰富的补体蛋白,也是补体三大激活途径的枢纽,其水解产物C3a和C3b在炎症反应和免疫防御中发挥关键作用。C5则是补体级联反应后期的核心成分,其裂解产物C5a是强效的炎症介质,C5b则启动膜攻击复合物(MAC)的形成。
作为先天免疫的助手,补体系统帮助机体抵御病原体的入侵,在维持健康和组织稳态方面发挥着关键作用。不过,补体系统一旦过度激活,便会引发炎症风暴,进而引发一系列疾病,如溶血性疾病、炎症性疾病、退行性疾病等[3]。这一机制为补体药物的开发提供了理论基础。
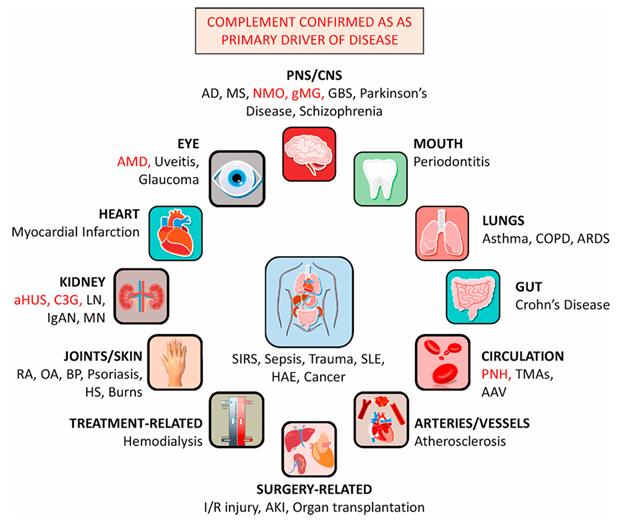
补体介导的多种疾病[4]
破冰之旅:突围罕见病,平地起惊雷
尽管补体的致病机制早在20世纪初就被认识,其药物开发却障碍重重。补体网络极其复杂,牵一发而动全身,稍有不慎便会破坏免疫平衡,这使得药物开发难度极大。直到2007年,彼时距离补体的首次发现已过去112年,第一款补体药物Soliris(依库珠单抗)成功问世,终于打破了补体成药僵局。
依库珠单抗通过特异性结合补体C5,阻止其活化,从而抑制膜攻击复合物的形成,进而减少血管内溶血事件的发生。依库珠单抗不仅彻底改变了阵发性睡眠性血红蛋白尿症(PNH)患者无药可用的困境,也开启了一个补体药物治疗时代。
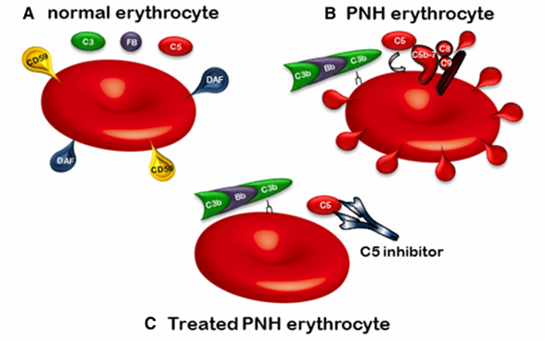
C5抑制剂治疗PNH的机制[5]
十年后,Ultomiris(瑞利珠单抗)作为Soliris(依库珠单抗)的升级版面世,将给药周期从2周延长至8周,大大减轻了患者的治疗负担。随着疾病谱的扩大及市场渗透,Ultomiris(瑞利珠单抗)的销售额已经在2024年反超一代产品。两代C5产品的成功也使得其开发商Alexion Pharmaceuticals声名鹊起,最终被阿斯利康以390亿美元的高价收购。这一交易充分彰显了资本对补体赛道战略价值的认可。
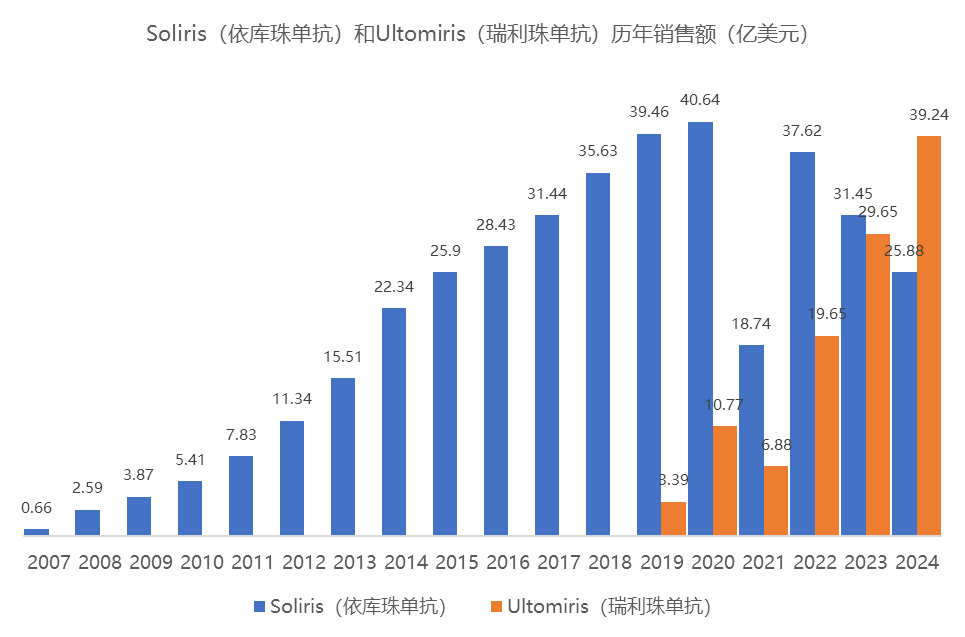
依库珠单抗从C5打开了补体成药的窗口,此后陆续问世的补体C3抑制剂、CFB抑制剂、CFD抑制剂等大多借鉴了从PNH切入的研发策略。截至目前,全球已有6款C5靶向药物上市,市场竞争日趋激烈,各大制药公司也在积极探寻差异化竞争策略。
星火燎原:补体药物“跨界”常见病
随着科学认知的深化,补体系统的“跨界”潜力逐渐显现。补体系统在免疫调节、炎症反应和组织损伤中的核心地位,使其成为众多疾病的潜在治疗靶点,远超最初的罕见血液疾病范畴。
依库珠单抗再次打头阵。2017年,Soliris(依库珠单抗)在III期REGAIN研究数据的支持下,成为了重症肌无力(MG)近60年来获批的首个新药,填补了该领域长期存在的治疗空白,也标志着补体药物开始涉足更为广泛的免疫性疾病领域。
2024年,诺华的CFB抑制剂Fabbalta(伊普可泮)在美国获批治疗IgA肾病。在III期APPLAUSE-IgAN临床研究中,伊普可泮将患者的蛋白尿水平降低了31%,并减缓了肾功能下降速度。这一突破性进展不仅为IgA肾病的精准治疗开辟了新途径,也为补体药物在免疫性疾病领域解锁了一片全新的区域。
补体药物在眼科领域也有用武之地。2019年,FDA批准依库珠单抗用于治疗视神经脊髓炎谱系障碍(NMOSD),为这一严重疾病带来转机;2023年上市的补体C3环肽抑制剂Syfovre(pegcetacoplan)则在年龄相关性黄斑变性(AMD)的晚期并发症——地图样萎缩(GA)上取得突破,成为该领域首个获批的靶向治疗药物。这些成果验证了补体系统在视网膜疾病治疗中的作用,全方位展示补体药物的广泛治疗益处。
适应症版图的扩张带来了市场量级的跃迁:全球PNH患者不到20万人,而MG患者超70万人,GA患者逾500万人,IgA肾病患者近千万人。而受众人群规模的扩容势必产生更高的商业价值,全球补体药物市场规模逐年增容便是有力证明。
补体药物的成功跨界,本质是对“补体异常激活”这一共性病理机制的深度挖掘。不同疾病虽临床表现迥异,却共享C3沉积、膜攻击复合物损伤等核心致病通路。补体药物的一路突围实现了从“罕见病破冰”到“常见病破局”的商业价值飞跃,也标志着补体药物研发从摸索走向成熟的重要转变。
总结
从偶然发现到全面发展,补体走过了百余年的漫长历程。如今,补体药物已形成多层次技术矩阵,涵盖单抗、小分子抑制剂、环肽、核酸适配体等多种形式,呈现出百花齐放的态势。同时,补体药物的适应症不断拓展,从罕见血液疾病延伸至免疫性疾病、眼科疾病等多个领域,展现出广阔的治疗前景。
而今,补体药物的征途远未抵达终点。看似分散的疾病突破,实则在勾勒一个更宏大的未来图景:补体系统作为免疫网络的关键开关,正在被赋予重塑疾病治疗范式的使命。随着补体系统在更多病理领域的机制被解析,这股曾经沉默百年的免疫暗流必将掀起更大的浪潮。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


