Nat Cell Biol :高尔基体里的神奇尺寸过滤器
来源:生物探索 2024-10-12 13:32
本研究旨在解决长久以来未完全理解的顶端膜蛋白在上皮细胞中的极性排序机制。
膜蛋白是细胞生命活动中至关重要的分子,它们不仅参与物质运输、信号传导,还帮助维持细胞的结构稳定性。在多种细胞类型中,尤其是上皮细胞,膜蛋白的极性排序确保了细胞的正常功能发挥。一个典型的例子是肠道上皮细胞,它们在吸收和分泌过程中依赖于膜蛋白的极性排序【1】。肠道上皮细胞的顶端膜面向肠腔,负责吸收营养物质,如葡萄糖和氨基酸,而基底侧膜则面向血液循环系统,将吸收的营养物质传递给血液。如果这些膜蛋白的极性排序出错,细胞将无法正常吸收和运输营养。极性排序过程将膜蛋白正确分配到顶端和基底侧膜区域,确保细胞不同区域能够执行特定的功能。
尽管已有大量研究揭示了基底侧膜蛋白的排序机制,例如通过氨基酸序列中的“邮政编码”信号引导其准确定位【2】,但还不清楚顶端膜蛋白的排序机制。过去的研究提出了多种顶端膜蛋白排序的假设,包括脂质相分离、糖基化以及通过跨胞体转运等【3,4】,但这些假设并不能普遍适用于所有顶端膜蛋白。因此,顶端膜蛋白的极性排序机制依然是生物学中的未解之谜。
近日,来自范德堡大学的Christian de Caestecker和Ian G. Macara在Nature Cell Biology上发表了题为A size filter at the Golgi regulates apical membrane protein sorting的文章,旨在解决长久以来未完全理解的顶端膜蛋白在上皮细胞中的极性排序机制。

研究人员注意到顶端膜蛋白通常具有较小的胞质结构,而基底侧膜蛋白则更大。因此他们想探讨这种结构差异是否与蛋白质在高尔基体中的分类有关。为了检测高尔基体中的“尺寸过滤器”效应,研究人员使用了RUSH(retention using selective hooks)系统,该系统可以通过添加生物素同步释放特定蛋白质到高尔基体。通过向Crb3、Ace2和Muc1等顶端膜蛋白增加不同大小的胞质尾部,研究人员发现:当胞质结构较小(如原始的Crb3蛋白)时,蛋白质可以快速从高尔基体转运到顶端膜;当胞质尾部增大时(通过化学手段附加不同标签),这些蛋白的高尔基体出口显著延迟,部分蛋白甚至错误地定位到基底侧膜。
研究人员进一步假设,Pals1蛋白与Crb3的结合可能会影响其从高尔基体的运输。因为Pals1是一个较大的细胞质蛋白,它与Crb3在内质网和高尔基体中形成复合体,但理论上需要在高尔基体分离以减少Crb3的细胞质尺寸,确保其正常运输。研究人员构建了不能与Crb3分离的突变体Pals1。荧光标记的Crb3和Pals1的共定位和运输情况显示,正常的Pals1在Crb3离开高尔基体之前分离,这样Crb3可以顺利通过尺寸过滤器。然而,Pals1突变体显著延迟了Crb3从高尔基体的出口,这表明Pals1的及时分离是Crb3定位的关键步骤。
为了证明尺寸过滤机制不仅限于Crb3,研究人员选用了其他顶端膜蛋白,如Ace2和Muc1,来测试其胞质结构的变化对高尔基体运输的影响。研究人员发现Ace2和Muc1的实验结果与Crb3相似,胞质结构扩大的蛋白质运输时间显著延长,表明尺寸过滤器的作用具有普遍性,不仅限于单一蛋白。
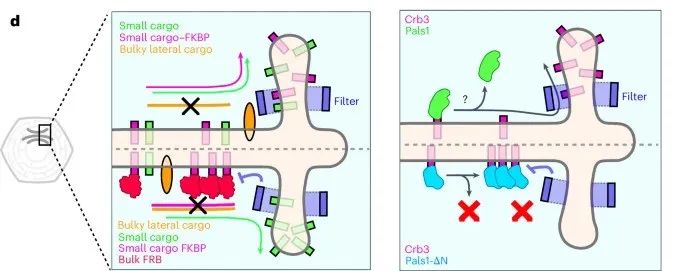
图1:该研究提出的模型图,解释了高尔基体的“尺寸过滤器”如何通过细胞质尾部的大小来筛选顶端膜蛋白(Credit: Nature Cell Biology)
综上所述,研究人员采用了一种合成生物学方法,使用了Crb3、Ace2和Muc1等代表性的顶端蛋白作为实验对象。通过结合一种链霉亲和素结合肽,使蛋白质暂时停留在内质网中,直到通过生物素触发蛋白质同步释放到高尔基体。实验中还增加了蛋白质的胞质结构,以观察其对高尔基体运输的影响。
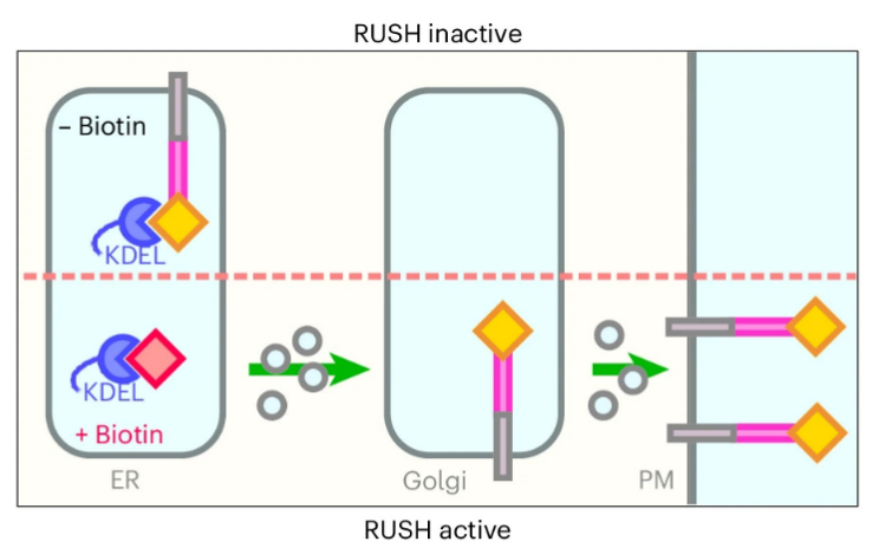
图2:RUSH系统的示意图。在没有生物素的情况下,带有SBP标签的转运蛋白通过与定位于内质网的链霉亲和素-KDEL相互作用被滞留在内质网中。向培养基中添加生物素后,这种相互作用被破坏,促使转运蛋白向前运输(Credit: Nature Cell Biology)
1. Koji Hase. Et al. AP-1B−Mediated Protein Sorting Regulates Polarity and Proliferation of Intestinal Epithelial Cells in Mice, Gastroenterology 145, 625-635, 2013.
2. Legouis, R. et al. Basolateral targeting by leucine-rich repeat domains in epithelial cells. EMBO Rep. 4, 1096–1102 (2003).
3. Youker, R. T. et al. Multiple motifs regulate apical sorting of p75 via a mechanism that involves dimerization and higher-order oligomerization. Mol. Biol. Cell 24, 1996–2007 (2013).
4. Scheiffele, P., Peranen, J. & Simons, K. N-glycans as apical sorting signals in epithelial cells. Nature 378, 96–98 (1995).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


