Dev Cell:CDK5RAP2导致γ-TuRC部分闭合可以激活微管成核
来源:生物探索 2024-10-01 12:19
本文验证了哺乳动物脑组织是内源γ-TuRC纯化的优质来源,并且解析了一种CMG模块装饰的部分闭合的γ-TuRC构象。
人类的γ-微管蛋白环状复合体(γ-TuRC)是一个由微管蛋白、GCP2、GCP3、GCP4、GCP5、GCP6、MZT1、MZT2、肌动蛋白以及几种γ-TuRC相关蛋白组成的多蛋白复合体,为细胞骨架微管的成核提供模板。干扰γ-TuRC的功能会导致轴突生长受阻【1】、有丝分裂纺锤体形成缺陷【2】,并引发严重的发育障碍【3】。γ-TuRC介导的微管成核通常在细胞质中被抑制,其活性仅限于中心体和其他微管组织中心(MTOC)中。在已知的脊椎动物γ-TuRC结构中【4-9】,γ-微管蛋白环都处于开放构象,和体内微管的13原丝的结构并不吻合。因此,γ-TuRC需要从开放构象转变为闭合构象才能聚合微管,但是这种构象转变在分子层面的机制尚不清楚。
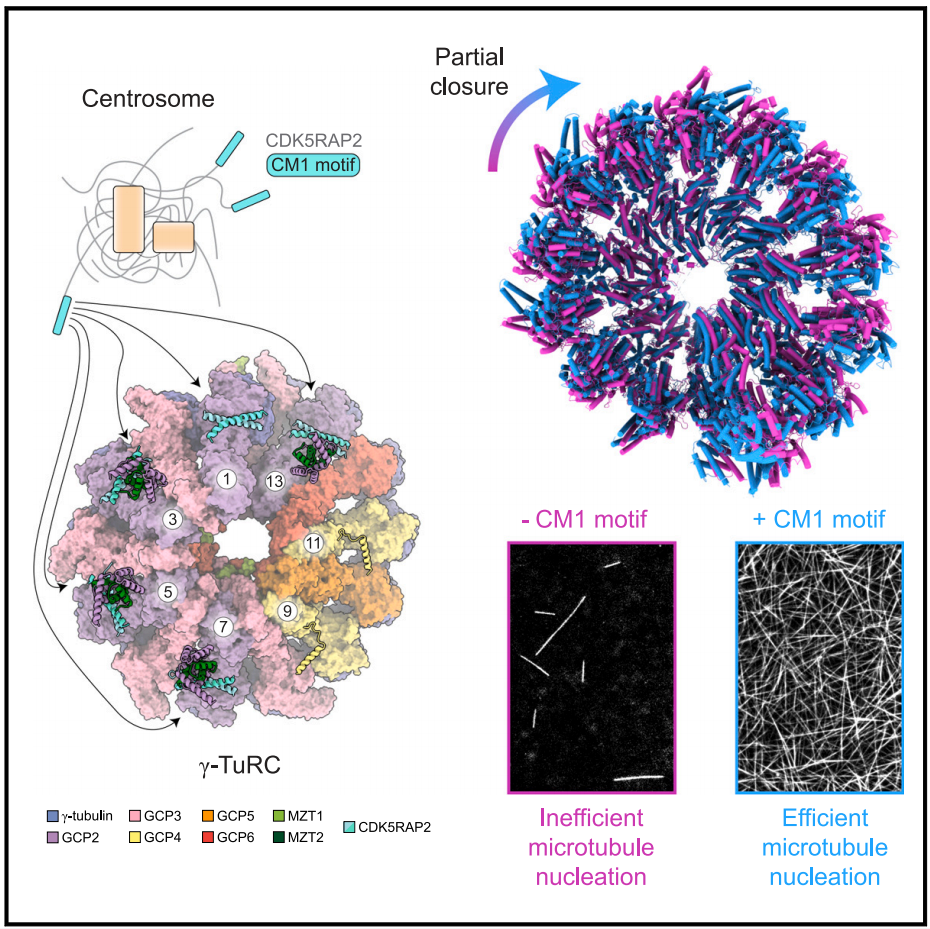
已知有一些微管相关蛋白能将γ-TuRC募集到MTOC,还可以激活其微管成核活性,其中的代表是包含中心体小分子1(CM1)基序的一类蛋白质。CM1基序通常位于蛋白质的N端,如果蝇的中心体蛋白(centrosomin)、裂殖酵母的Mto1、酿酒酵母的Spc110p和人类的CDK5RAP2。人类的CDK5RAP2定位于中心体和高尔基体,通过RNA干扰消耗CDK5RAP2会减少中心体的微管成核,但不影响γ-TuRC的组装【10,11】。与许多中心体蛋白的典型特征一样,CDK5RAP2富含α螺旋,且有形成卷曲螺旋的倾向。CDK5RAP2的N端CM1基序有57个氨基酸,其中59-88号氨基酸的序列(也被称为γ-TuRC成核激活子,γ-TuNA)能够在体外刺激γ-TuRC的微管成核【11,12】。
CDK5RAP2的58-92号氨基酸此前在人类γ-TuRC的结构中出现【13】。在这个结构中,CDK5RAP2形成了一个二聚的卷曲螺旋,仅结合在γ-TuRC上的单一位置(位于GCP2的C端GRIP2结构域、与GCP2的N端α螺旋结合的MZT2以及GCP6的C端GRIP2结构域之间)。虽然CDK5RAP2的存在似乎将与GCP2和与GCP6结合的γ-微管蛋白的局部构象变为了更接近体内微管晶格的排列,但大多数γ-微管蛋白仍表现为开放构象。CDK5RAP2或许还可以结合在γ-TuRC上的其他位置以促进γ-微管蛋白环的闭合,但目前还缺乏这种假设的结构证据。
瑞士ETH Zürich的Michal Wieczorek团队(第一作者为Yixin Xu)在Developmental Cell上发表了文章Partial closure of the γ-tubulin ring complex by CDK5RAP2 activates microtubule nucleation。在本研究中,研究人员从猪脑中纯化出了结合CDK5RAP2 CM1基序片段的内源γ-TuRC蛋白,并通过冷冻电子显微镜解析了其结构,发现了γ-TuRC的一种新型构象,在这种构象中,CDK5RAP2的卷曲螺旋片段与MZT2和GCP2-NHD亚基一起形成了多个复合体,研究人员称之为“CMG模块”。
CMG模块锚定在γ-TuRC外表面至少4个结合位点上,每个结合位点以GCP2亚基为中心。研究人员意外地观察到多个CMG模块的存在以及γ-微管蛋白围绕整个γ-TuRC的显著位移和旋转,其中超过一半的γ-TuRC蛋白亚基处于一种与闭合构象非常接近的状态。这种γ-TuRC的部分闭合是通过形成新的γ-微管蛋白间相互作用和GCP亚基间相互作用实现的,而CMG模块的存在能够使这些相互作用界面保持稳定。
此外,研究人员还纯化了体外重组的γ-TuRC蛋白。在完全重组的系统中,含有50个氨基酸的CDK5RAP2 CM1基序片段能够强烈激活重组的人类γ-TuRC,且这种激活依赖于CMG特异性界面的存在。结果表明,哺乳动物γ-TuRC中构象调节的位点主要在于GCP2和GCP3构成的γ-TuRC亚基,而不是另一侧的GCP4/5/6亚基。
综上所述,本文验证了哺乳动物脑组织是内源γ-TuRC纯化的优质来源,并且解析了一种CMG模块装饰的部分闭合的γ-TuRC构象。这一新构象为γ-TuRC相关研究提供了结构证据,表明在没有α/β-微管蛋白的情况下其他辅助蛋白可以将γ-TuRC转变为闭合状态,为γ-TuRC的激活途径提供了新的见解,解释了其在体外较低微管成核活性的原因。
模式图(Credit: Developmental Cell)
参考文献
1. Ahmad FJ, Joshi HC, Centonze VE, Baas PW. Inhibition of microtubule nucleation at the neuronal centrosome compromises axon growth. Neuron. 1994;12: 271–280.
2. Hutchins JRA, Toyoda Y, Hegemann B, Poser I, Hériché J-K, Sykora MM, et al. Systematic Localization and Purification of Human Protein Complexes Identifies Chromosome Segregation Proteins. Science. 2010; 1181348.
3. Scheidecker S, Etard C, Haren L, Stoetzel C, Hull S, Arno G, et al. Mutations in TUBGCP4 alter microtubule organization via the γ-tubulin ring complex in autosomal-recessive microcephaly with chorioretinopathy. Am J Hum Genet. 2015;96: 666–674.
4. Wieczorek M, Urnavicius L, Ti S-C, Molloy KR, Chait BT, Kapoor TM. Asymmetric Molecular Architecture of the Human γ-Tubulin Ring Complex. Cell. 2020;180: 165–175.e16.
5. Consolati T, Locke J, Roostalu J, Chen ZA, Gannon J, Asthana J, et al. Microtubule Nucleation Properties of Single Human γTuRCs Explained by Their Cryo-EM Structure. Dev Cell. 2020;53: 603–617.e8.
6. Liu P, Zupa E, Neuner A, Böhler A, Loerke J, Flemming D, et al. Insights into the assembly and activation of the microtubule nucleator γ-TuRC. Nature. 2019;578: 467–471.
7. Zimmermann F, Serna M, Ezquerra A, Fernandez-Leiro R, Llorca O, Luders J. Assembly of the asymmetric human γ-tubulin ring complex by RUVBL1-RUVBL2 AAA ATPase. Science Advances. 2020
8. Wieczorek M, Ti S-C, Urnavicius L, Molloy KR, Aher A, Chait BT, et al. Biochemical reconstitutions reveal principles of human γ-TuRC assembly and function. J Cell Biol. 2021;220.
9. Würtz M, Zupa E, Atorino ES, Neuner A, Böhler A, Rahadian AS, et al. Modular assembly of the principal microtubule nucleator γ-TuRC. Nat Commun. 2022;13: 473.
10. Fong K-W, Choi Y-K, Rattner JB, Qi RZ. CDK5RAP2 is a pericentriolar protein that functions in centrosomal attachment of the gamma-tubulin ring complex. Mol Biol Cell. 2008;19: 115–125.
11. Choi Y-K, Liu P, Sze SK, Dai C, Qi RZ. CDK5RAP2 stimulates microtubule nucleation by the gamma-tubulin ring complex. J Cell Biol. 2010;191: 1089–1095.
12. Yang S, Au FKC, Li G, Lin J, Li XD, Qi RZ. Autoinhibitory mechanism controls binding of centrosomin motif 1 to γ-tubulin ring complex. J Cell Biol. 2023;222.
13. Wieczorek M, Huang T-L, Urnavicius L, Hsia K-C, Kapoor TM. MZT Proteins Form Multi-Faceted Structural Modules in the γ-Tubulin Ring Complex. Cell Rep. 2020;31: 107791.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


