患者出现严重不良反应,下一代CRISPR基因编辑公司暂停临床试验
来源:生物世界 2023-01-10 10:51
严重的意外不良事件涉及试验参与者经历长时间的低血细胞计数,这种情况需要持续输血和生长因子支持。虽然还不足以达到停止研究的阈值,但Graphite决定根据不断变化的数据这样做。
Graphite Bio公司宣布其首位接受nulabeglogene autogtemcel(简称nula-cel)临床试验的患者意外出现严重不良事件,因此暂停这项基于基因编辑的镰状细胞病临床试验。受此影响,Graphite Bio公司股价大跌,当前市值仅1亿美元,相比上市之初的10亿美元,市值已跌去90%。

Graphite Bio公司表示,这名患者于2022年8月接受nula-cel疗法,这是一款下一代基因编辑自体造血干细胞疗法,旨在直接修正HBB基因突变来治疗镰状细胞病。但患者接受治疗后经历了长时间的低血细胞计数,这种情况需要持续输血和生长因子支持。
Graphite Bio公司的下一代基因编辑自体造血干细胞疗法是基于CRISPR-Cas9基因编辑技术,不同的是,该公司开发了一种名为 UltraHDR 的基因编辑平台,将CRISPR基因编辑从切割和破坏基因转变为定向精确修复DNA,即同源定向修复(HDR)。
具体来说,UltraHDR 平台首先找到突变基因位点,然后通过公司专有的 HiFi Cas9 进行高精度DNA切割,以去除致病基因中不正确的DNA序列。最后,使用AAV6递送正确的DNA序列模板,从而重写患者DNA,恢复基因功能。
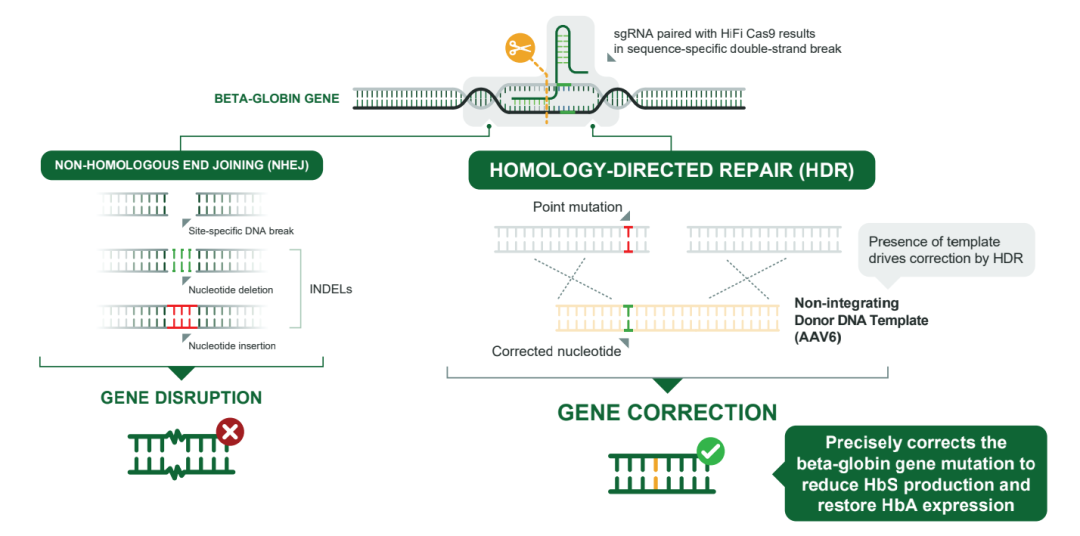
虽然不良事件不符合停止临床研究的要求,且患者实现了研究定义的中性粒细胞植入,且没有证据显示骨髓增生异常,但Graphite Bio公司已向FDA报告了该事件,并在得出不良事件可能与治疗有关的结论后,停止了这项临床研究。
严重的意外不良事件涉及试验参与者经历长时间的低血细胞计数,这种情况需要持续输血和生长因子支持。虽然还不足以达到停止研究的阈值,但Graphite决定根据不断变化的数据这样做。
Graphite Bio表示,到2023年中期,公司将不再满足nula-cel初始概念验证数据的指导要求,也将不会在2024年中期之前为治疗β-地中海贫血的候选药物GPH102提交IND申请。该公司表示,将努力提高运营效率,以将公司现金流维持到2026年。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


