《自然·癌症》:巨噬细胞又有新花招!复旦大学发现全新巨噬细胞亚型促肝癌的新机制
来源:奇点糕 2024-10-07 12:50
该研究利用整合多组学分析的方法,为全面了解HCC肿瘤微环境的空间异质性和细胞之间的相互作用提供了新的视角,并强调了VIM高表达巨噬细胞和Treg细胞相互作用在HCC进展中的作用。
所谓的肿瘤微环境的异质性,是指肿瘤细胞及其周围的细胞、基质和分子环境之间存在的多样性和差异。这些多样性和差异不仅影响肿瘤的生物学行为,还会对治疗策略的选择和疗效产生影响。因此,深入理解肿瘤微环境的异质性,对开发更有针对性的抗肿瘤治疗策略至关重要。
近期,复旦大学王红阳/陈磊团队发表了一项研究,他们利用共检测索引(CODEX)技术,深入解析了HCC肿瘤微环境的空间异质性。通过绘制HCC单细胞空间蛋白质组学图谱,他们鉴定出了三种代表不同预后,基因组学和分子特征的空间分型(SP-HI,SP-PF,SP-LI)。
随后在整合了多组学的分析数据后,他们进一步揭示了一种此前并未被关注过的巨噬细胞类型——波形蛋白(VIM)高表达巨噬细胞在HCC进展中的作用。具体来说,VIM高表达的巨噬细胞可通过分泌IL-1β,来增强调节性T(Treg)细胞的免疫抑制功能,进而促进肿瘤进展和免疫逃逸。
研究发表在《自然·癌症》上[1]。

论文首页截图
为了全面量化HCC肿瘤微环境的空间异质性,研究团队使用了CODEX技术(这是一种高分辨率的新型多重成像技术,能够在单细胞水平上同时检测36种生物标志物[主要包括像CD4阳性和CD8阳性T细胞、Treg细胞、巨噬细胞在内的免疫细胞,以及内皮细胞、成纤维细胞和胆管细胞等],可揭示细胞空间分布及其相互作用),对401例HCC患者的肿瘤样本进行了空间可视化分析,并构建了HCC肿瘤微环境的空间单细胞蛋白质组学图谱。
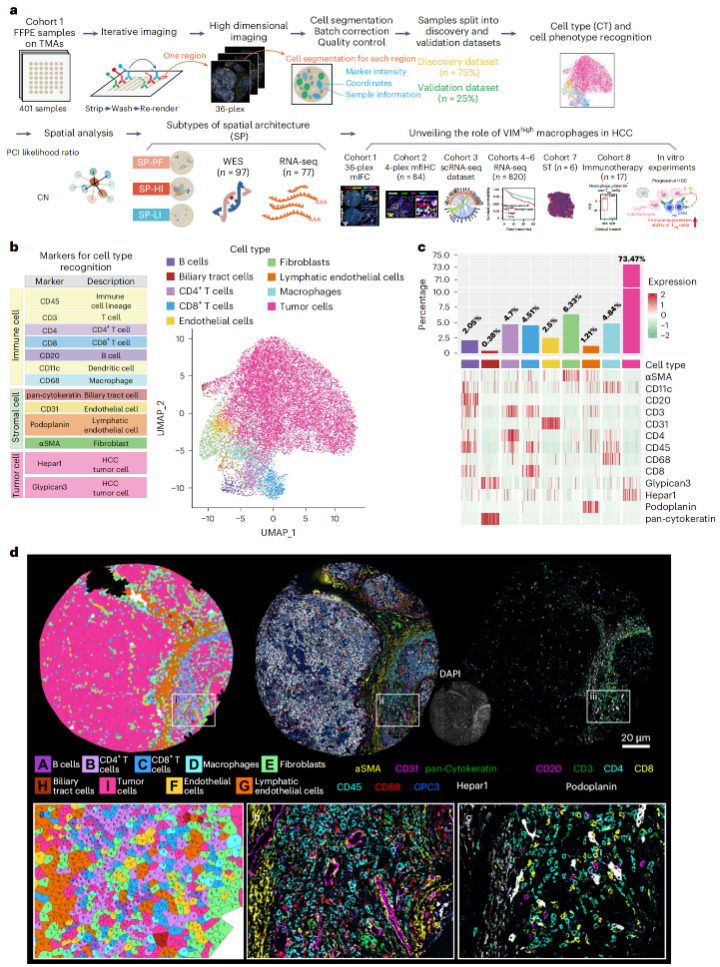
分析结果显示,HCC样本中共存在9大细胞类型和67种细胞表型,且不同类型的细胞(如c-Myc阳性细胞、Ki-67阳性细胞)会根据其状态和激活信号,聚集在一起,形成特定的细胞微环境。
进一步利用细胞表型和空间信息对肿瘤样本进行分类后,研究团队识别出多种与HCC预后相关的空间分型(SP),它们分别是高免疫细胞和基质浸润模式(SP-HI)、高增殖细胞主导的模式(SP-PF)和低免疫细胞和基质浸润模式(SP-LI)。其中SP-HI和SP-PF模式与患者复发风险增加有关,SP-LI与患者复发风险降低有关。

三种模式代表不同预后
在基因组学和分子特征上,SP-HI模式肿瘤微环境中有较高水平的免疫细胞和基质细胞浸润(如B细胞、CD4阳性T细胞、CD8阳性T细胞等),提示处于该模式下的患者可能对免疫治疗更敏感。
SP-PF模式肿瘤微环境中则富集了大量的增殖细胞,显示出较高的细胞增殖活动,同时免疫细胞浸润较稀疏。提示处于该模式下的患者可能更适合靶向肿瘤增殖的疗法。
SP-LI模式肿瘤微环境表现出低增殖性、低CD8阳性T细胞浸润,以及高CTNNB1突变率,提示该模式下的患者可能无法从免疫治疗中获益。
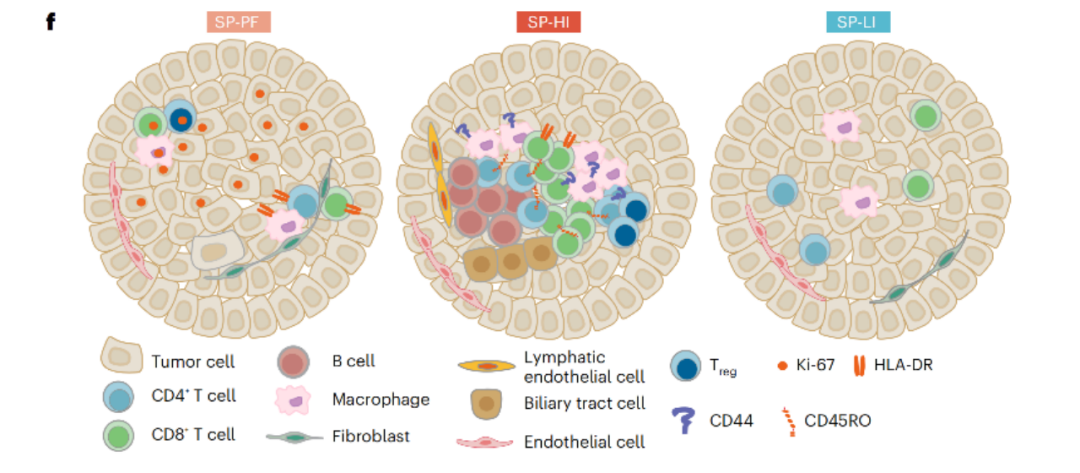
三种模式的分子特征
在识别出不同空间模式后,通过生存分析,研究人员发现了一类特殊的巨噬细胞类型,VIM高表达巨噬细胞。该细胞类型在SP-HI、SP-PF模式下显著富集,并与肿瘤复发和转移风险升高密切相关。
接下来,利用空间共定位,以及对单细胞RNA测序、空间转录组数据进行分析后,研究人员发现,VIM高表达巨噬细胞和Treg细胞在空间上的相互作用是导致HCC进展的关键(VIM高表达巨噬细胞和Treg细胞存在空间共定位,且与早期HCC相比,晚期和转移性HCC中,VIM高表达巨噬细胞和Treg细胞间相互作用指数更高)。
最后通过体外功能实验表明,VIM高表达巨噬细胞可通过分泌IL-1β,来增强Treg细胞的免疫抑制功能,进而促进肿瘤进展和免疫逃逸。
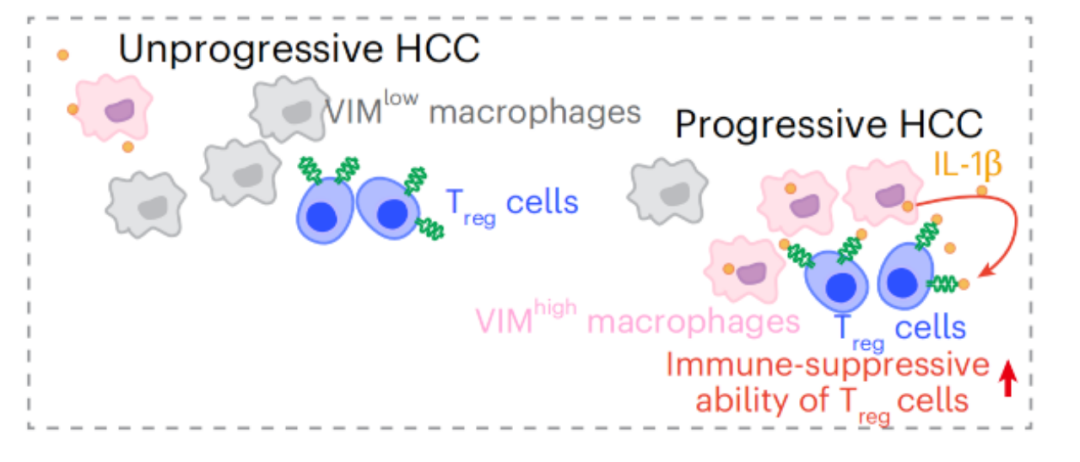
机制图
总之,该研究利用整合多组学分析的方法,为全面了解HCC肿瘤微环境的空间异质性和细胞之间的相互作用提供了新的视角,并强调了VIM高表达巨噬细胞和Treg细胞相互作用在HCC进展中的作用。此外,研究识别出的不同空间模式也为患者的分层管理和制定针对性的治疗策略提供了帮助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


