Science:西湖大学万蕊雪&施一公团队在次要剪接体领域再获重要突破
来源:生物世界 2024-03-15 17:40
研究团队首次提出了两种剪接体的正确组装的分子机理模型,为理解两条剪接通路间的精准识别奠定了重要的基础。
《科学》杂志在线发表了题为:Structural basis of U12-type intron engagement by the fully assembled human minor spliceosome(完全组装的次要剪接体与U12型内含子结合的结构基础)的研究论文,这是剪接体结构与机理研究的又一个重大突破!
这一成果来自西湖大学特聘研究员万蕊雪团队和结构生物学讲席教授施一公团队(西湖大学副研究员白蕊为第一作者)。该研究首次报道了完全组装的次要剪接体的高分辨率三维结构,展示了在U12型内含子上组装过程的关键构象——预催化剪接体前体(precursor pre-catalytic spliceosome,定义为“pre-B复合物”),解析并鉴定了56个蛋白和6种RNA(pre-mRNA和5种snRNA),整体分辨率高达3.3埃。
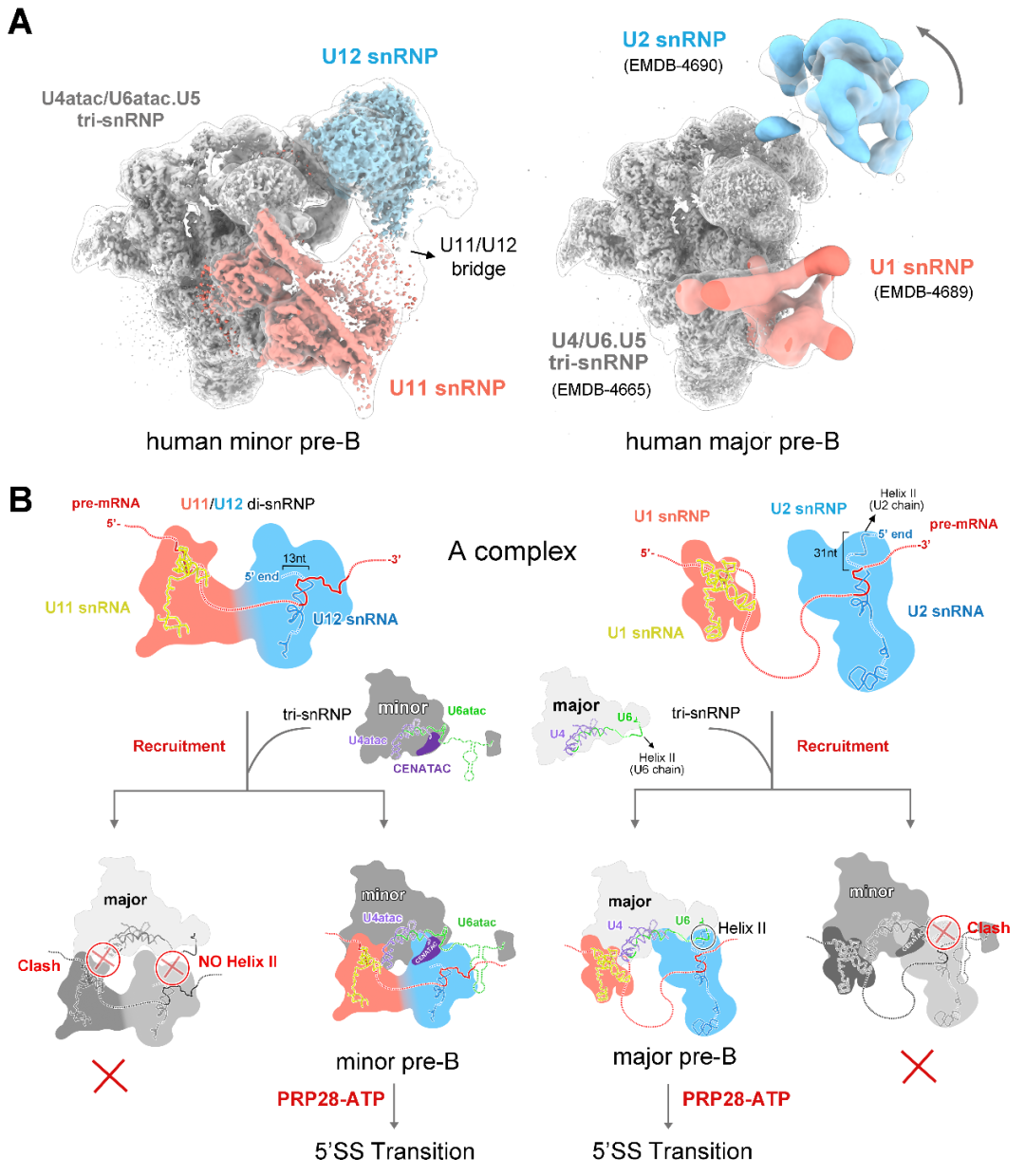
该结构第一次展示了组成次要剪接体的全部5种snRNP(U11、U12、U4atac、U6atac和U5 snRNP),揭示了次要剪接体在组装过程中对U12型内含子上5'剪接位点识别的分子机理,解决了剪接体激活过程中5'剪接位点如何逐步进入活性位点的重要问题;通过与主要剪接体的结构比较分析了U2型和U12型内含子识别的结构基础,首次从分子层面提出了主要、次要剪接体如何区分剪接位点并正确完成组装的模型。
2021年,万蕊雪&施一公团队首次在 Science 发文报道次要剪接体相关成果,3年之后的今天,他们仍然是世界上唯一报道次要剪接体结构的团队。
不次要的次要剪接体
次要,并不意味着不重要,相反,在人体生命活动中,次要剪接体扮演着重要的角色,它们就好比电影中的配角,虽然出场次数不多,但却对剧情的发展起着至关重要的作用。
要理解次要剪接体,首先要理解什么是剪接体。
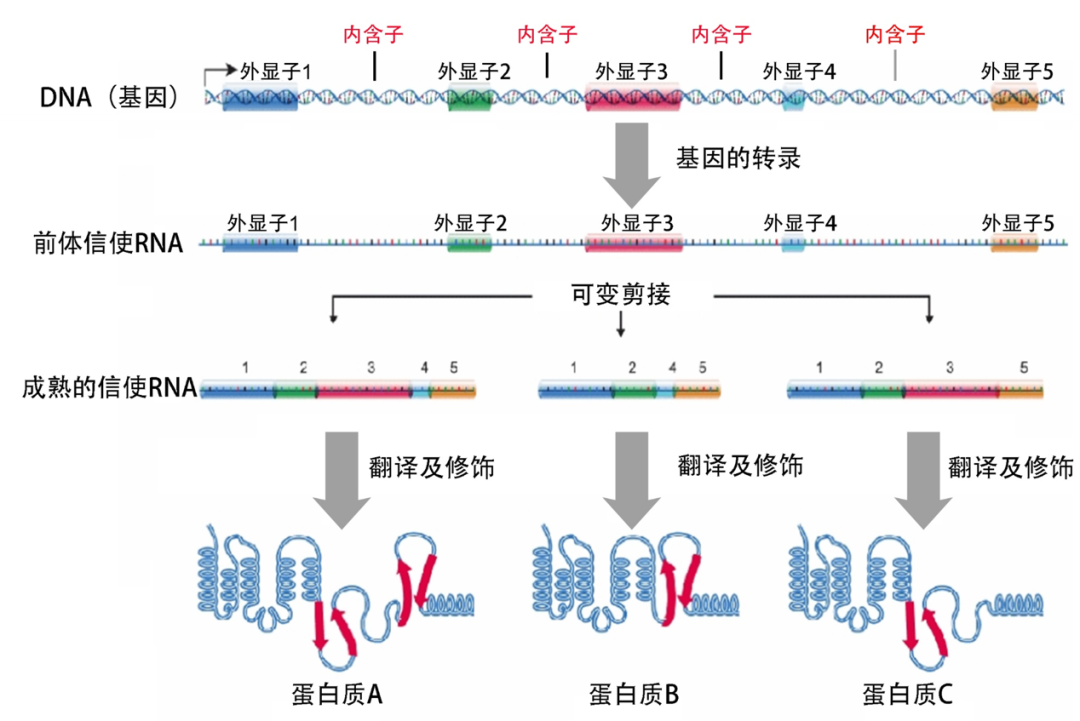
生物学最核心的法则之一“中心法则”,描述了自然界所有生物得以生存必需的基因表达过程——储存在DNA(基因)中的遗传信息通过“转录”被传递给信使RNA(mRNA),再通过“翻译”从RNA传递给执行生命活动的蛋白质。
 基因表达与RNA剪接
基因表达与RNA剪接
那么,基因中所有的信息都有效吗?如果不是的话,谁来承担甄别的角色呢?
如果说,每个人的基因是一部宏伟的电影剧本,那么,RNA剪接则是一位神奇的魔术师,轻轻一挥魔术棒,剪掉“无效”的遗传信息(内含子)、接上“有效”的信息(外显子),最终拼接成一部完整的人生电影,而这位魔术师手中神奇的魔法棒,就是剪接体——主要由上百种蛋白质和5条核内小RNA(snRNA)组成。
每一次剪接,剪接体需要首先识别剪接位点。在20世纪90年代,科学家在研究分析中发现了一类非经典的内含子剪接序列(5'剪接位点为AT,3'剪接位点为AC),一种全新的剪接体开始进入科学家的视野。经过研究发现,它与此前发现的剪接体相似却也不同——同样包含5条snRNA,但是其中四种是新的(U11、U12、U4atac、U6atac)。
由于发现较晚、在细胞内的含量很低(含量占所有剪接体的百分之一),这类剪接体被命名为次要剪接体(minor spliceosome,又被称为U12型剪接体)。那些含量较多的剪接体则被命名为主要剪接体(major spliceosome,又被称为U2型剪接体)。
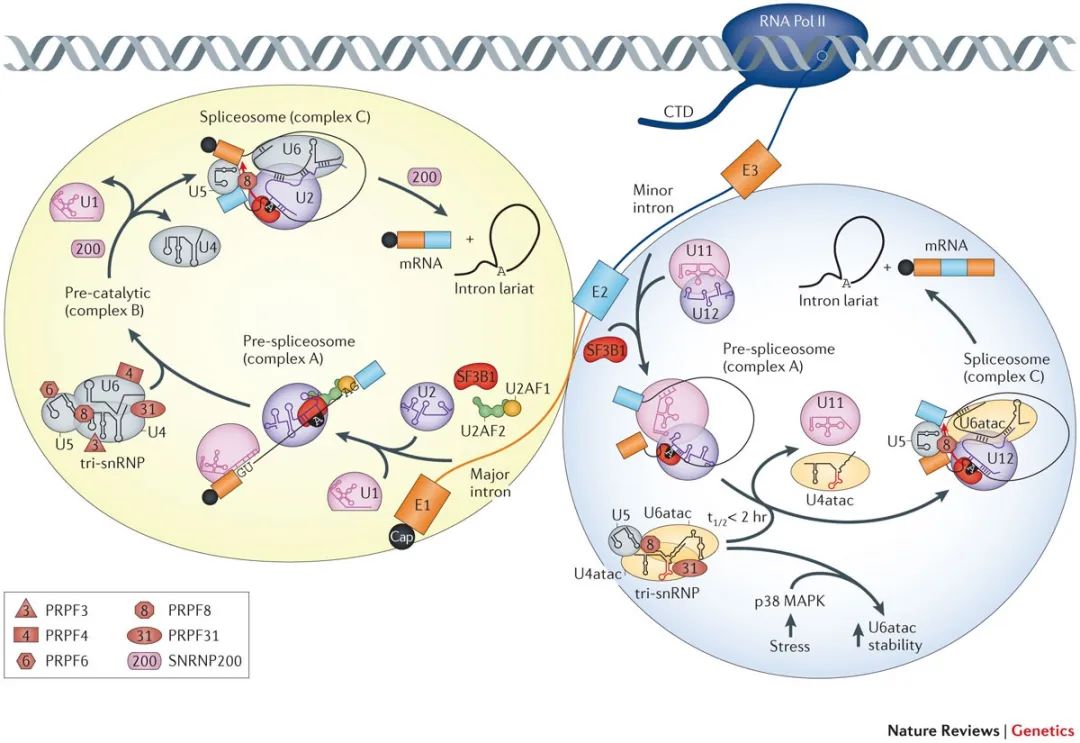
主要剪接体和次要剪接体(Scotti and Swanson, Nature Review Genetics, 2016)
由此,次要剪接体开始出现在历史舞台上。但是针对它的研究却仅只有寥寥数笔,为什么?
因为含量极少,丰度只有主要剪接体的百分之一。这导致它们发出的信号会被占大多数的主要剪接体掩盖掉,也很难设计高效的体外实验。
其次,次要剪接体十分复杂,且十分不稳定,因此极难从细胞中被分离。
但是,这并不意味着次要剪接体不重要。
这些基因与许多重要的细胞基本生命活动密切相关:比如DNA的复制与修复、RNA转录与翻译、囊泡运输和电压门控离子通道活性相关的基因等。次要剪接的异常则会导致多种疾病的发生,例如单纯性生长激素缺乏症、早发性小脑共济失调、骨髓发育异常综合征等。
因此,次要剪接体如何组装、催化?它由什么蛋白质组成?两条剪接通路如何区分、如何协作或相互影响?等等,这些问题亟待科学家探索和发现。
解析完全组装的次要剪接体结构
此前,在主要剪接体领域,万蕊雪&施一公团队已经解析出几乎全过程的10种状态的结构,对于主要剪接体的实验方法、性质特点都有着自己独到的见解。
而研究团队并没有忽视那不到0.5%的存在——次要剪接体。早在2018年,他们在规划剪接体未来研究计划时,就把次要剪接体列入计划当中。
2021年1月,Science 报道了世界上第一个次要剪接体的结构,这是他们第一次敲开了次要剪接体的大门。

这次的成果正是上一次的延续。
完成RNA剪接,需要至少10个不同状态的剪接体,2021年解析的是次要剪接体激活的状态,此次解析的是激活与前一步组装之间的状态——预催化剪接体前体(Pre-B复合物),也就是要“剪”但还没开始的那一步,这是组装过程中最复杂的复合物。
他们尝试从建立体外剪接实验入手。次要剪接体在细胞内含量极低,难以分离纯化。他们改造了pre-mRNA底物,通过控制体外剪接反应的离子条件、加入关键“动力源”蛋白ATPase/Helicase PRP28突变体等方法,成功得到了次要剪接体pre-B复合物状态。
这个状态包含了组成剪接体的全部5种snRNP组分,但是依旧无法看清全貌,因为这个状态蛋白组成多且极不稳定,各snRNP之间的相互作用并不紧密,于是,团队通过增加化学交联剂的方法,使得剪接体处于“不紧不松”的状态。
最后通过10万张冷冻电镜照片的收集,经过复杂且漫长的数据分析过程,他们解析出了人源次要剪接体处于完全组装状态的高分辨率三维结构——拥有56个蛋白和6条RNA(pre-mRNA和5种snRNA)。次要剪接体特有组分中的U11 snRNP和U4atac/U6atac.U5 snRNP的三维结构被首次揭示。
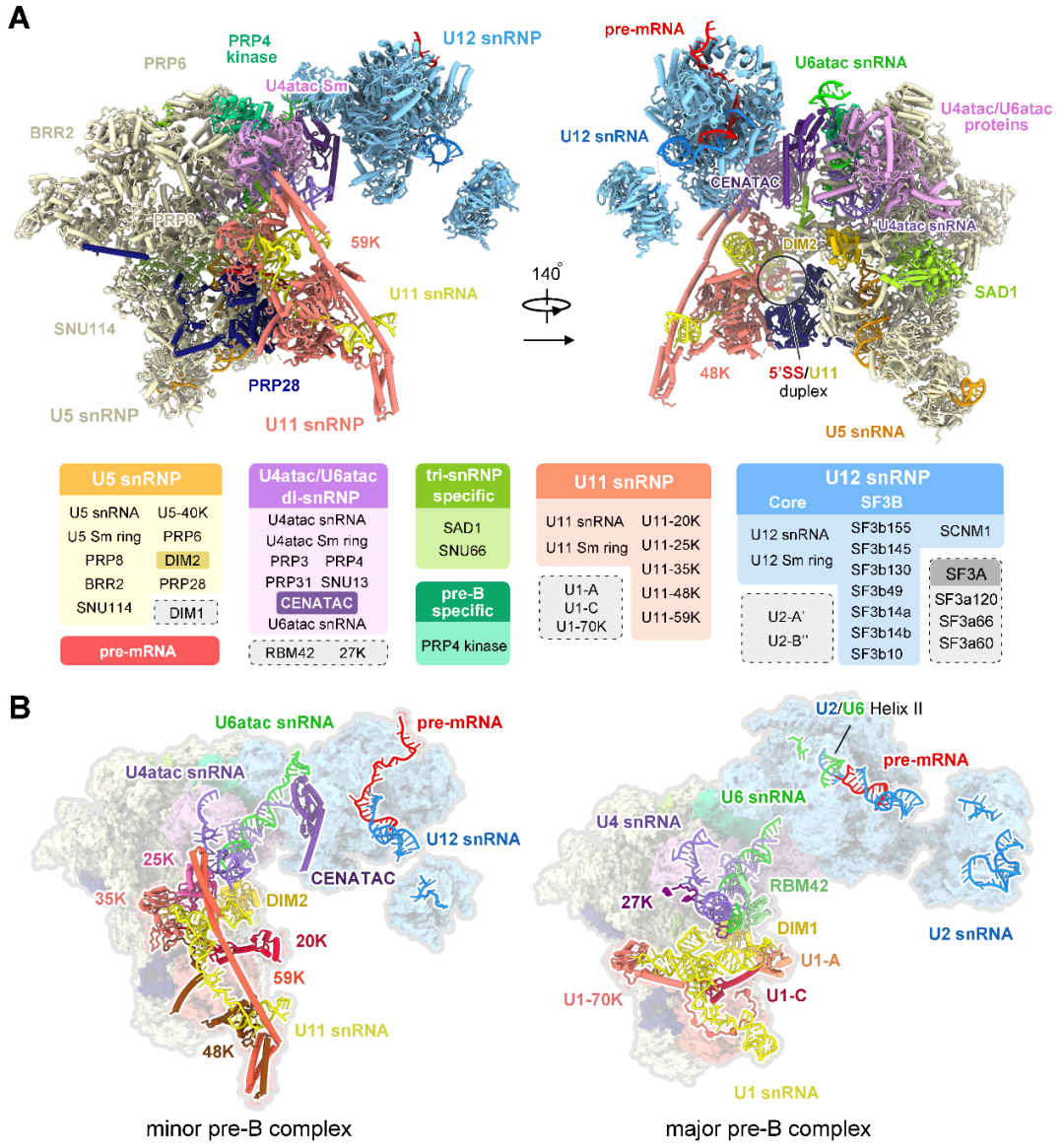
完全组装的次要剪接体的三维结构
鉴定了次要剪接体新的特异组分
从2021年研究项目启动,到2022年春天,不到一年的时间,研究团队以最快速度解析出了高分辨率结构。此前,我们已知主要剪接体中含有U1 snRNP,而次要剪接体中含有一个和U1 snRNP功能类似、却拥有十分独特的蛋白组成的U11 snRNP,但是二者为何如此不同却还是个谜。
解析结构之后,研究团队清楚地看到了U11 snRNP结构特征,12个蛋白参与识别并维持了独特的U11 snRNA的构象。更为重要的是,U11 snRNP部分的高分辨率结构清晰地揭示了U12型内含子5'剪接位点被U11 snRNP识别的结构基础。
然而,在次要剪接体preB complex的另一边,却还有一些组分没有被鉴定出来。
U4atac、U6atac两条snRNA被认为分别与主要剪接体中U4、U6 snRNAs具有类似功能,它们之间在序列上几乎没有相似性,但却折叠成了相似的三维结构,这很好地解释了为什么两条剪接通路中可以共用部分蛋白。可是在此之外,我们还清楚地看到,在这两条次要剪接体特有的RNA旁边,紧紧结合着一些未知的成分,但我们始终看不清它们的样子。
次要剪接体与主要剪接体的结构及组装机制差异
又经过近一年的实验、查找和鉴定,研究团队终于鉴定出了位于U4atac/U6atac.U5 tri-snRNP部分鉴定出两个次要剪接体的特异组分蛋白CENATAC和DIM2的结构信息。其中,CENATAC特异性识别U4atac snRNA的5'末端以及U6atac中部茎环结构。鉴定出的特异蛋白更好地解释了为什么次要剪接体和主要剪接体在招募成员的过程可以不出错。
次要剪接体中的U4atac/U6atac.U5 tri-snRNP和主要剪接体中的U4/U6.U5 tri-snRNP构象十分相似,在组装过程中,那些游离的蛋白如何“各就各位”?次要剪接体在门口竖起了标志——蛋白CENATAC和DIM2,那些游离的蛋白正确找到了对应的位置, 接下来的RNA剪接才得以顺利进行。
通过上述研究,团队首次提出了两种剪接体的正确组装的分子机理模型,为理解两条剪接通路间的精准识别奠定了重要的基础。
至此,这项研究划上了一个圆满的句号。

西湖大学剪接体团队(万蕊雪、施一公实验室)
西湖大学生命科学学院特聘研究员万蕊雪、讲席教授施一公为论文共同通讯作者;西湖大学生命科学学院副研究员白蕊为第一作者;清华大学生命学院博士生袁梦、科研助理张普和西湖大学生命科学学院科研助理罗婷参与了部分生化研究。北京协和医院教授黄超兰和原高级工程师高帅鑫在质谱分析方面提供了帮助;清华大学冷冻电镜平台主管雷建林博士及工程师杨帆博士在冷冻电镜数据收集方面提供了帮助;西湖实验室副研究员黄高兴宇在数据处理方面提供了建议。电镜数据采集于清华大学、西湖大学冷冻电镜平台,计算工作得到西湖大学和清华大学高性能计算平台的支持。该研究获得了西湖教育基金会和国家自然科学基金委的经费支持。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


