2022 ESMO:新药临床开发的风云变幻
来源:医药魔方 2022-09-22 17:43
先行者不一定都是成功者。当我们盯着药物分子开始follow时,不愿接受“带头大哥”的折戟沉沙,却幻想着自己是那个FIC(first in class)/BIC(best in
先行者不一定都是成功者。当我们盯着药物分子开始follow时,不愿接受“带头大哥”的折戟沉沙,却幻想着自己是那个FIC(first in class)/BIC(best in class)。对于临床研究中反映出的数据和趋势,更应深思背后的生物学机制并转化为新产品策略。
2022年ESMO大会已然落下帷幕,期间有惊喜、有失落、也有无奈。虽然本届会议,首次亮相的新靶点药物不多,但也有诸多受关注药物靶点仍在奋进中。在此,摘选了8个靶点10款药物的临床研究动态,让一起感受新药临床开发中的跌宕起伏。

图片来自ESMO官网
WEE1:先驱折戟,后继者追

5月,阿斯利康报告了奥拉帕利联合ATR抑制剂ceralasertib或WEE1抑制剂adavosertib二/三线治疗转移性三阴性乳腺癌(mTNBC)的II期临床研究(VIOLETTE研究)未取得让人满意的结果,并在二季度报中移除了WEE1管线。此举让adavosertib的临床开发全面终止,而Zentalis开发的ZN-c3在安全性方面的优势仍然让业界对WEE1靶标的表现充满期待。
1. IMP7068
2022 ESMO会议上,英派药业公布了WEE1抑制剂IMP7068的初步安全、PK和临床活性。此前,ASCO会议上也曾公布了9例患者的剂量递增研究初步数据,这一次患者人数已经增加至32例。不过,相对于彼时的数据,ESMO公布的安全性数据出现了剂量限制性毒性(DLT),3级及以上不良事件发生率也明显提高。
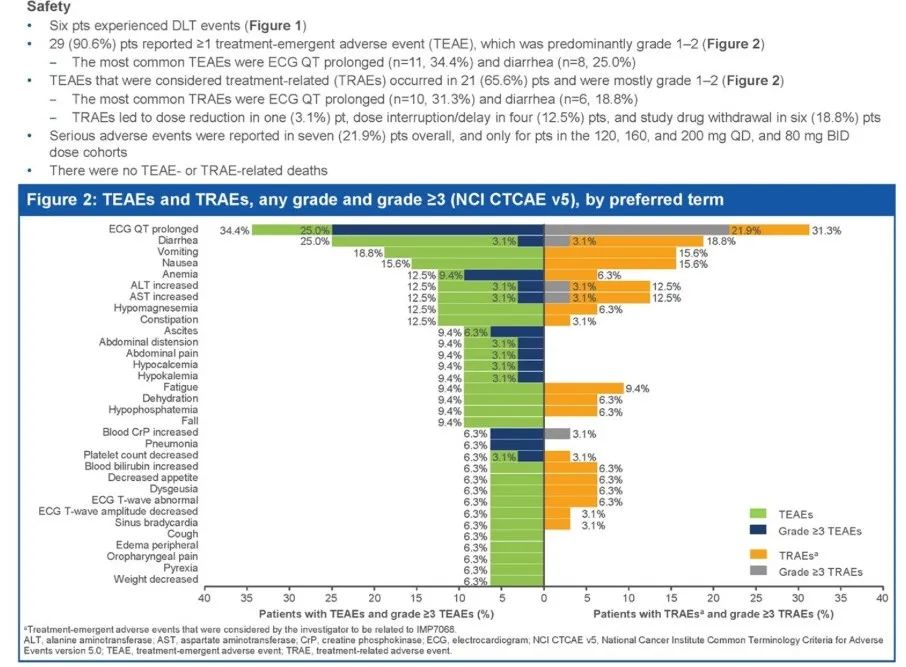
初步疗效方面,21例患者纳入评估,1例显示PR(4.8%)、10例SD(47.6%)。
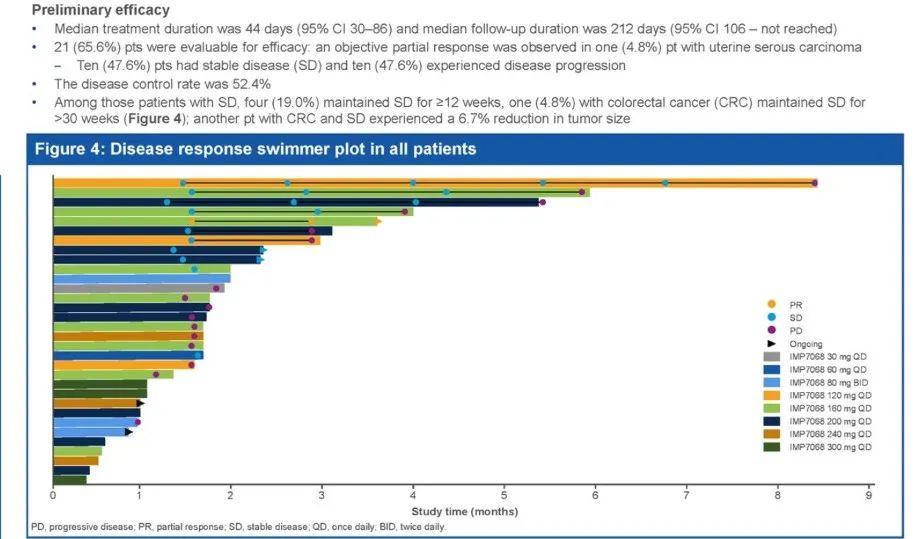
目前,IMP7068仍在进一步评估,以确定RP2D,并优化给药方案减轻心电图QT延长不良事件。
PRMT5:领头羊被退回,研发终止

似乎,我们已经看到第一代PRMT5抑制剂(GSK3326595等)安全性不佳的原因,认为其不结合PRMT5-MTA复合物,对MTAP缺失型癌症没有实现选择性,而从头到尾地抑制PRMT5导致出现副作用。然而,对于体内蛋白来说,谁又是孤立存在的,蛋白间的相互作用导致构象变化,令蛋白酶小分子的开发经验仅在PRMT5中失灵吗?
2. PRMT5
GSK在2021年报中寥寥数语结束了与Epizyme的合作,归还PRMT5抑制剂GSK3326595权益,但当时并未过多提及终止合作的原因。随着Epizyme被收购,GSK3326595也未作价在标的中。
2022 ESMO会议上,GSK3326595在晚期实体瘤上的安全性和疗效数据公开,或许让我们看到了终止的原因。
结果显示,大多数患者在数据截止时已经停止了治疗 (211/218, 97%)。在实体瘤患者和NHL患者中分别只有3例反应,各队列的中位治疗时间仅为1.87 (0-34.8) 个月。95%的患者发生治疗相关不良事件,一半患者(51%)出现3/4级治疗相关不良事件,多数患者(70%)都经历了剂量中断,56%的患者降低了剂量,13%的患者因不良事件终止治疗。
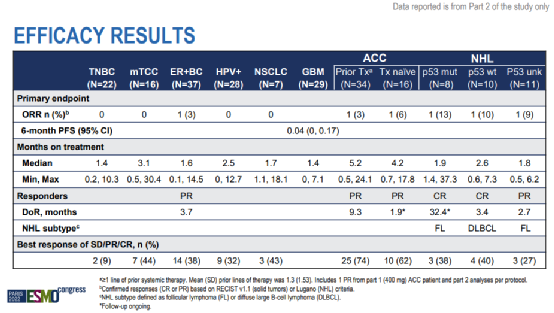
作为一款小分子抑制剂,总要留给充足的时间来发挥疗效,而不足两个月的中位治疗时间、几乎一半患者发生3/4级治疗相关不良事件,也就注定了这款药物只能在少数幸运患者中起效。真实世界中,这样的幸运总是太少,也只能继续期待下一代PRMT5抑制剂的表现。
TIGIT:罗氏退让,谁争首发

罗氏TIGIT抗体tiragolumab接连在小细胞肺癌/非小细胞肺癌的两项临床研究中(SKYSCRAPER-02/SKYSCRAPER-01)错失主要终点,直接阻碍了罗氏TIGIT疗法的敲钟步伐。尚在临床开发中的其他TIGIT药物,又增加了成为首发的概率。
3. ociperlimab
目前,除tiragolumab外,domvanalimab、MK-7684A、vibostolimab和欧司珀利单抗(ociperlimab)也都进入了III期临床研究,多数药物也有在本届ESMO亮相。
不过,MK-7684A、tiragolumab、domvanalimab更多的是公布临床进展动态,欧司珀利单抗则公布了一项NSCLC领域的剂量扩展数据。

AdvanTIG-105旨在探索欧司珀利单抗联合替雷利珠单抗和化疗在晚期复发实体瘤患者中的药物代谢特征、安全性及抗肿瘤疗效。在RP2D剂量下,84例患者接受治疗。
安全性方面,48.8%的患者发生了3级及以上不良事件,严重不良事件发生率约占16.7%。疗效方面,在鳞状NSCLC患者中ORR达到57.5%,非磷NSCLC患者中为54.8%,且全部为部分缓解。
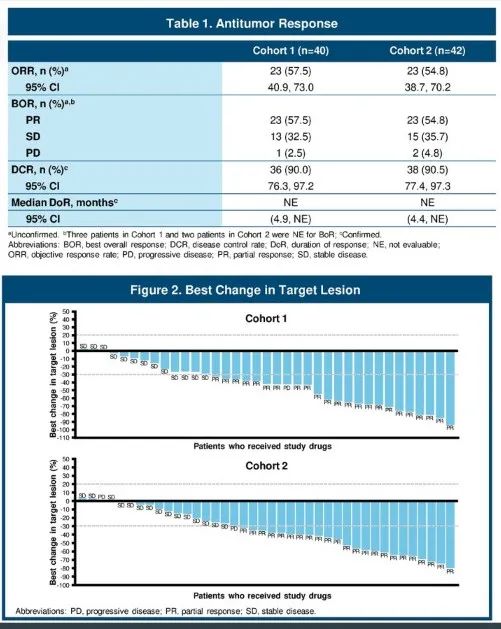
AdvanTIG-105研究仅是目前的初步临床数据,欧司珀利单抗联合替雷利珠单抗及化疗的两项III期临床研究(AdvanTIG-301/2)也在进行中,期望能够最终展现出优胜于替雷利珠单抗联合化疗(RATIONALE 304/307)的临床表现。
除了TIGIT抗体,百济神州还公布了DKK1抑制剂DKN-01的联合替雷利珠单抗和化疗作为一线治疗晚期胃食管腺癌 (GEA) 的DisTinGuish研究结果。DKN-01是DKK1靶点四款临床药物之一,且开发速度也较为靠前。DisTinGuish研究的初步结果显示,DKK1表达高低对于患者的ORR表现有所影响,似乎对mPFS影响较小。
DKN-01联合替雷利珠单抗和化疗在DKK1高表达患者中ORR达到90%,低表达患者中则为56%。对于DKK1高表达患者而言,PD-L1表达水平的高低对ORR的影响较小,甚至在PD-L1低表达患者中表现更优。mPFS方面,DKK1高表达患者为11.3个月,低表达患者则达到12个月。mOS数据尚无成熟,截至数据截止时只有44%的患者死亡,研究的中位持续时间为15.7个月。

不过,这项研究纳入的患者人数不多,在疗效和安全性方面仍需要进一步的评估,相关临床II期研究正在进行中。生物标志物对不同疗效指标的影响,显然值得进一步探索。
CEACAM5:赛诺菲的肿瘤希望

赛诺菲在肿瘤领域的探索并不顺利,SERD口服药物amcenestrant接连遭受II期和III期研究失败,并终止了开发。6月初,赛诺菲和再生元“分手”,Libtayo的全球开发、商业化权利回归再生元。肿瘤领域在临床后期的产品也就只剩下了CEACAM5抗体偶联药物tusamitamab ravtansine。
4. tusamitamab ravtansine
ESMO会议上,tusamitamab ravtansine公布了两项临床动态。其中,CARMEN-GC01是一项评价tusamitamab ravtansine联合雷莫芦单抗治疗胃或胃食管结合部腺癌 (GA/GEJA)患者的II期、开放标签的单臂研究。

另一项则是tusamitamab ravtansine在表达癌胚抗原相关细胞粘附分子5 (CEACAM5) 的结直肠癌或胃癌患者中的安全性和有效性临床数据。癌胚抗原相关细胞粘附分子5 (CEACAM5) 是一种糖蛋白,与在正常上皮组织中的表达水平相比,在包括胃肠道、肺和乳腺在内的多种肿瘤组织中高度表达。
Tusamitamab ravtansine是一种抗体偶联药物,通过由谷胱甘肽可切割的接头将靶向CEACAM5的人源化单克隆抗体与强效抗微管蛋白药物美登木素DM4链接而成,DAR为3.82。
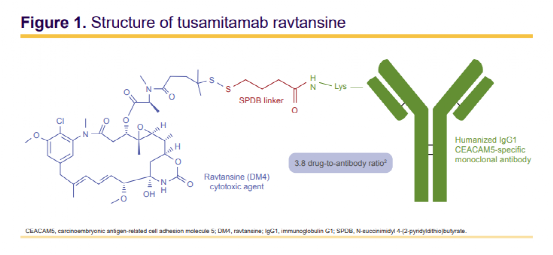
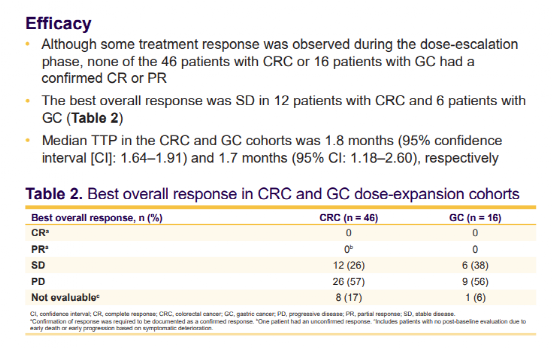
这项研究的数据显示,尽管在剂量递增阶段观察到治疗反应,但46例CRC患者和16例GC患者均未出现确认的CR或PR。12名CRC患者和6名GC患者的最佳总体反应为SD,CRC和GC队列的中位TTP分别为1.8个月和1.7个月。
目前,tusamitamab ravtansine在NSCLC领域的研究已经处于III期阶段,tusamitamab ravtansine在CRC和GC患者中进一步开发将侧重于联合治疗。Tusamitamab ravtansine有无能力为赛诺菲再开一扇“肿瘤之门”,自然值得关注。
ULK:潜在泛KRAS靶标

丝裂原活化蛋白激酶 (MAPK) 通路抑制激活Unc-51样自噬活化激酶 (ULK) 1/2并启动自噬以促进RAS/RAF突变癌症的存活。
5. DCC-3116
DCC-3116是潜在的选择性ULK1/2抑制剂的FIC药物,也是目前该靶标唯一的临床药物。DCC-3116能够有效抑制ULK1/2底物ATG13和ATG14的磷酸化以阻断自噬,在临床前研究中与MAPK通路抑制剂联合使用可产生增效或协同的抗肿瘤活性。

本届ESMO会议上,主要公布了一项DCC-3116单药活性的临床数据。结果显示,DCC-3116单药在结直肠癌、胰腺癌等多种携带不同KRAS亚型突变的瘤种中具有初步的临床迹象,部分患者实现了疾病稳定。
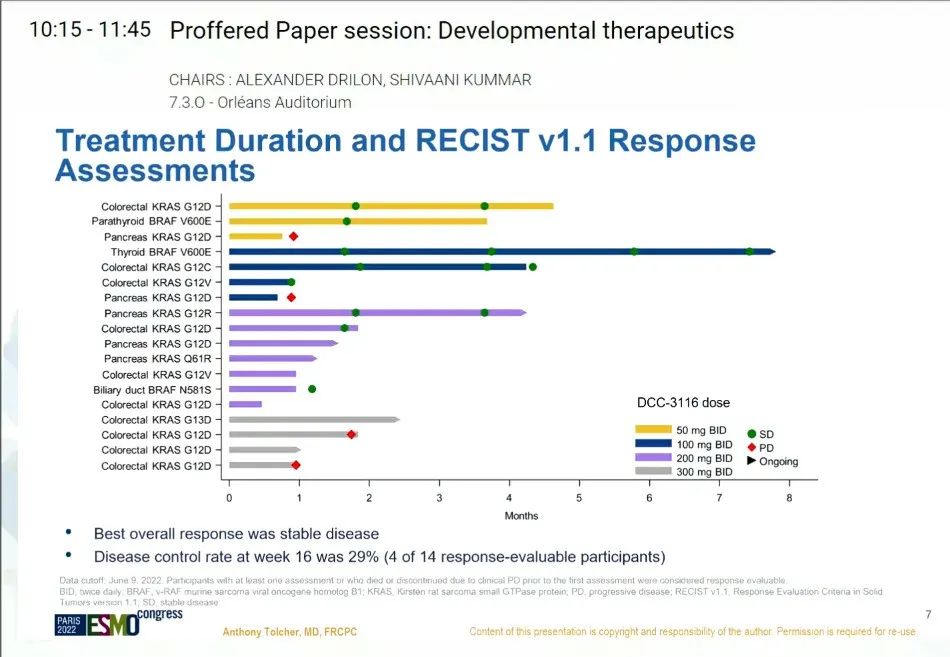
DCC-3116在50-300 mg BID剂量下耐受性良好,未发生剂量限制性毒性和治疗相关的严重不良事件。100-300 mg BID的剂量扩展也在进行中,以进一步表征安全性、PK和PD,并确定DCC-3116与MEK或KRAS G12C抑制剂联合使用的剂量递增起始剂量。
FGFR2: 高选择性曙光已现

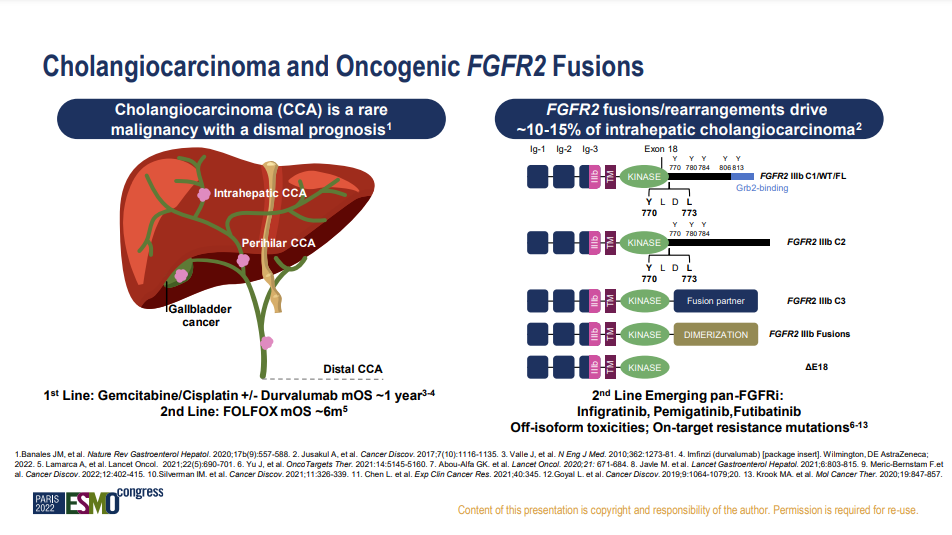
成纤维细胞生长因子受体(FGFR)属于酪氨酸激酶受体超家族亚族,由四种高度保守的跨膜受体酪氨酸激酶(FGFR1~4)和一种能够结合成FGF配体但缺乏细胞内激酶结构域的受体FGFR5(也称为FGFRL1)组成。靶向FGFR已成为治疗胆管癌 (CCA) 的一种有前途的策略,但缺乏选择性的FGFR抑制剂容易出现抑制FGFR1所导致的高磷血症等不良事件。
6. RLY-4008
胆管癌(CCA)是最常见的胆道恶性肿瘤。根据其位置,CCA可分为肝内、肝门周围或肝外CCA,早期症状隐匿,就诊时常为晚期。尽管FGFR抑制剂显示出显著的活性,但目前的FGFR抑制剂仅限于10-15%的FGFR2融合和重排的CCA患者,但存在非选择性的毒性和脱靶抗性突变。
RLY-4008是一种高效、选择性的口服小分子FGFR2抑制剂,目前正在开展治疗肝内胆管癌的临床研究。临床前数据显示,RLY-4008对FGFR2显示优异的选择性。

2022 ESMO会议公布的临床数据中,RLY-4008对于FGFR抑制剂初治的携带FGFR2融合和重排胆管癌患者,92%的患者实现肿瘤缩小,ORR达到63.2%。在RP2D剂量下,ORR更是高达88.2%,显著优于已上市和申请上市的非选择性FGFR抑制剂表现。
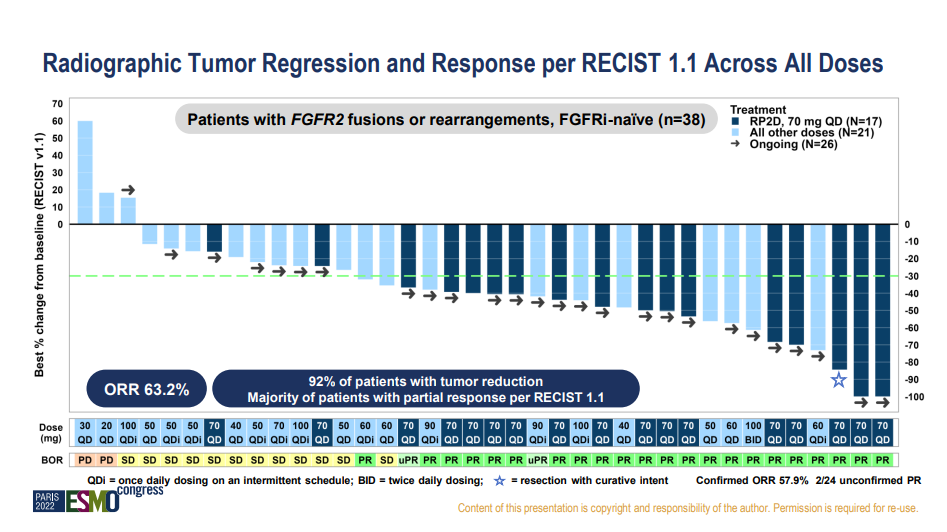
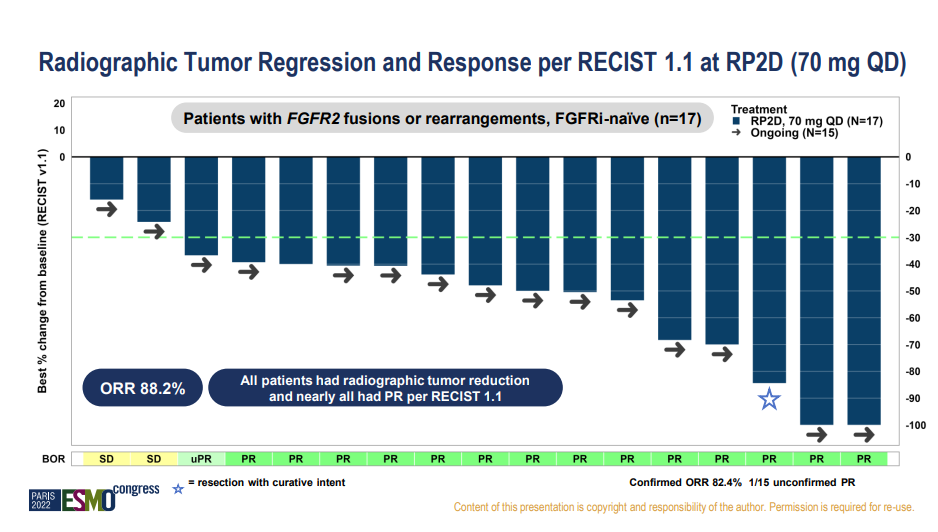
安全性方面,RLY-4008也表现出良好的耐受性,没有报告4级或5级不良事件,也没有出现高磷血症。RLY-4008有可能改变CCA治疗范式,受此数据鼓舞,Relay Therapeutics股价8日收盘上涨23%。
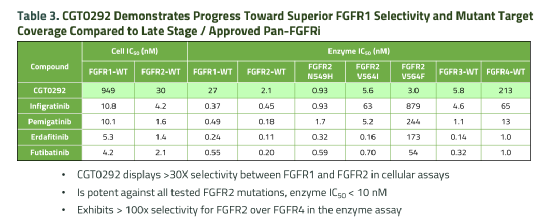
目前,临床研究中高选择性FGFR2小分子抑制剂并不多。CGT0292是Cogent Biosciences开发的一款FGFR2抑制剂,也在临床前的数据上显示出明显的选择性优势。
SERD:口服便利的阴晴圆缺

选择性雌激素受体降解剂 (SERD)以其可口服的给药优势,被认为在替换注射药物氟维司群存在便利性。然而,赛诺菲、罗氏的接连失利让SERD增添了黯淡之光,反倒是只有艾拉司群(elacestrant,RAD1901)成为首个也是目前唯一显示mPFS获益优于氟维司群的口服SERD,并已经提交上市申请。同一个靶点、一样的小分子却不一样的命运,除了药物设计、临床设计之外,还有多少需要思考的问题?
7. 艾拉司群
本届ESMO会议上,艾拉司群继续公布EMERALD研究的亚组分析,渴望的OS数据依旧没有出现。
艾拉司群已经公布过mPFS数据,显示艾拉司群在ESR1突变人群中的优势。不过,这样的优势并没有绝对的保障,能不能转化到OS获益,还需要最终的数据证明。
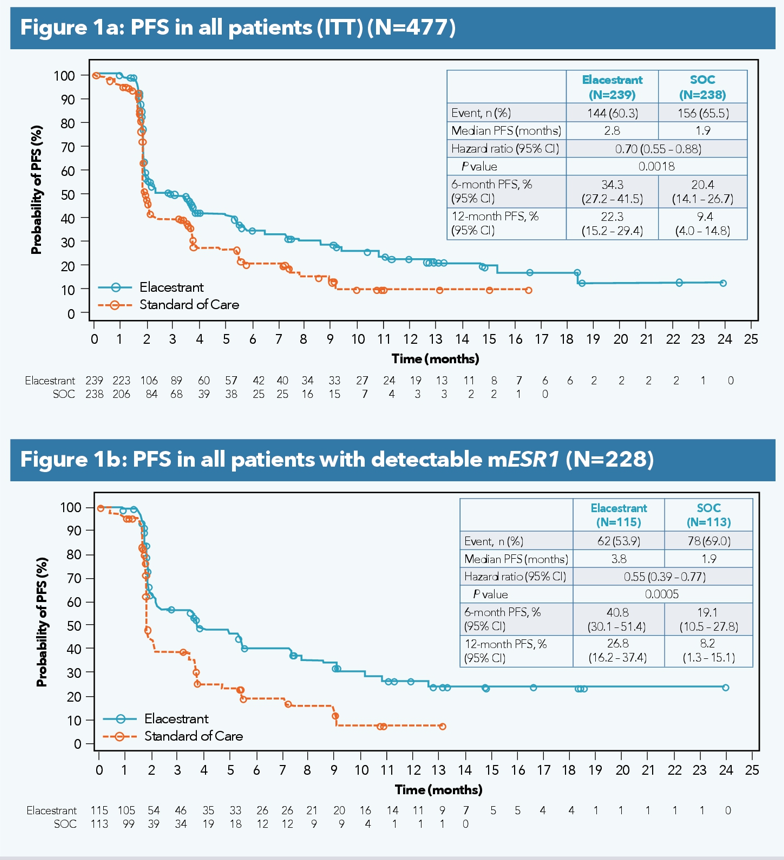
ASCO会议上公布的亚组分析显示,在未接受化疗的ESR1突变人群中,艾拉司群的mPFS优势更加明显(5.32 vs 1.91m)。
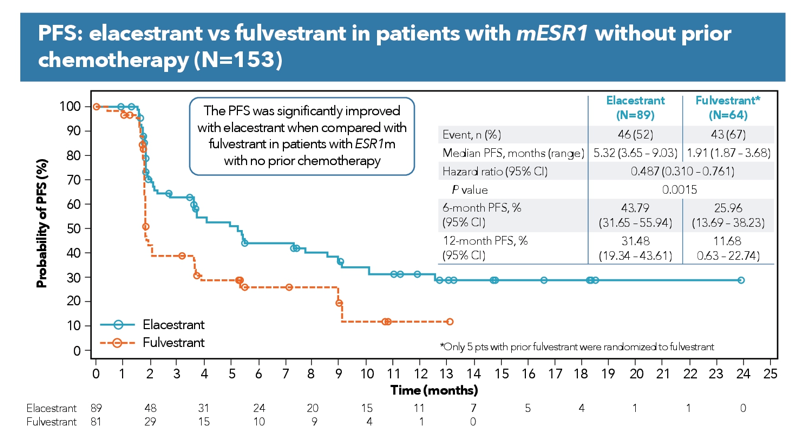
ESMO会议上,艾拉司群继续公布EMERALD研究PFS率的亚组分析结果。就数据而言,艾拉司群依旧保持着领先优势。值得注意的是,在ESR突变人群的12月后PFS率变化趋势显著减缓。
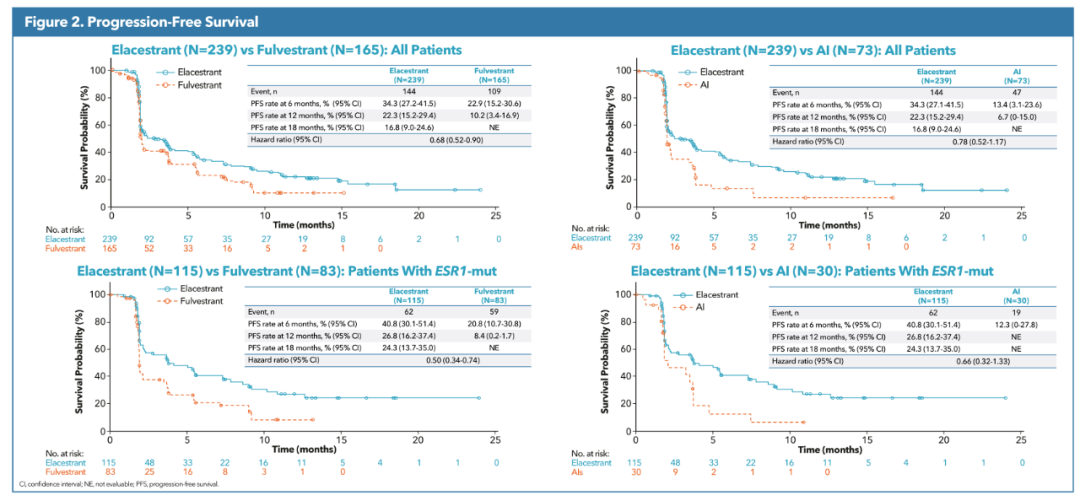
不过,艾拉司群最终的临床价值仍需要衡量生存期获益数据。虽然艾拉司群具有口服的便利性,但给药频率更高,相对应经济负担也会加重。同时,艾拉司群在安全性上似乎并没有显著优势,反倒是相对氟维司群增加了3/4级不良事件的发生概率。
8. giredestrant (GDC-9545)
Giredestrant在本届ESMO会议上公布了两项临床进展数据,分别为新辅助疗法的coopERA研究生物标志物亚组分析和已经宣布研究失败的acelERA结果数据。
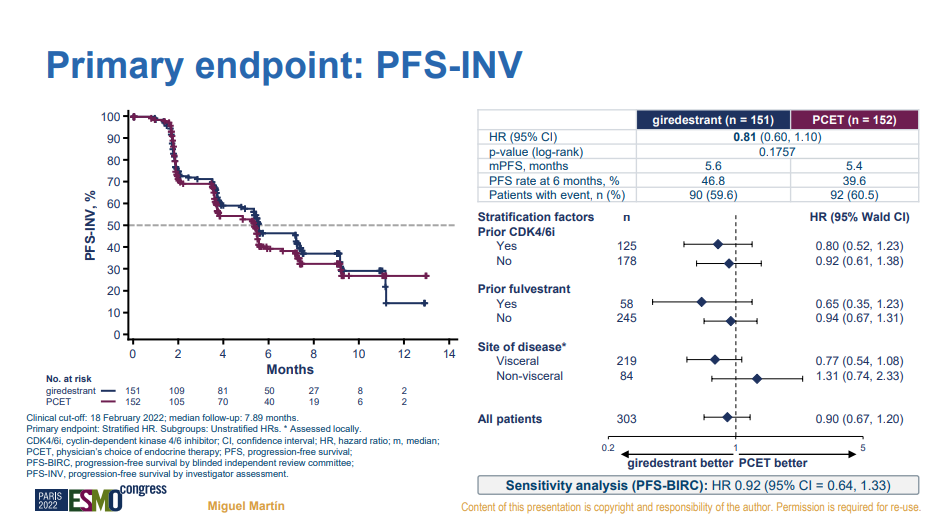
4月,罗氏曾在2022 Q1财报数据上透露giredestrant(GDC-9545)治疗ER+/HER2-局部晚期或转移性乳腺癌的II 期acelERA试验未达到无进展生存期的主要终点。2022 ESMO会议上公布了acelERA研究的详细数据。结果显示,giredestrant虽然在6个月PFS率上显示些许优势,但并没有在mPFS上体现差异化。不过,在敏感性分析上,giredestrant和氟维司群似乎有着相似的趋势。
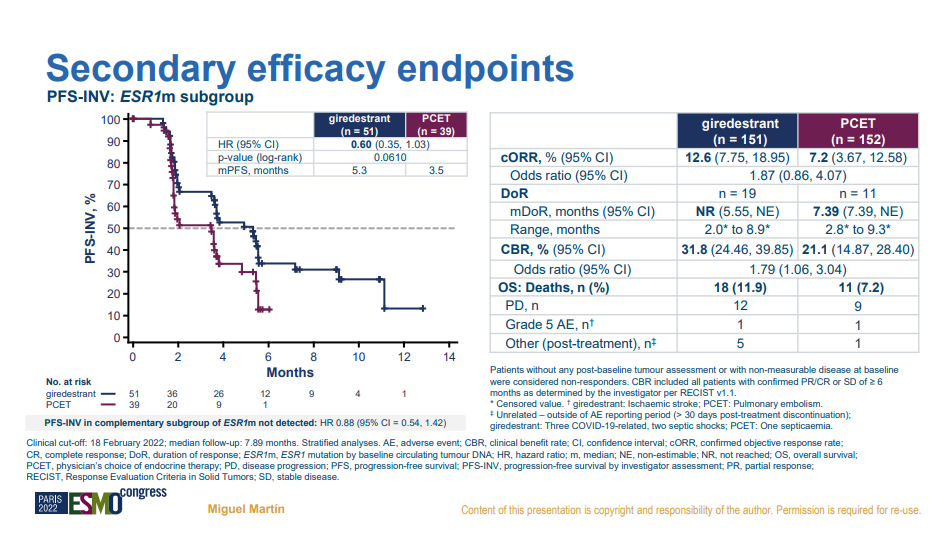
针对ESR1突变的次要终点分析上,giredestrant同样显示数字上的优势(mPFS:5.3 vs 3.5m),遗憾的是也未达到p值的显著。
9. amcenestrant
AMEERA-3、acelERA两项研究的相继失利,也让赛诺菲终止了amcenestrant的临床开发。AMEERA-3研究的详细结果在本届ESMO会议上公布。
数据显示,amcenestrant同样也在ESR1突变人群中具有获益的潜力优势,mPFS延长了1.7个月,但也未达到显著差异。
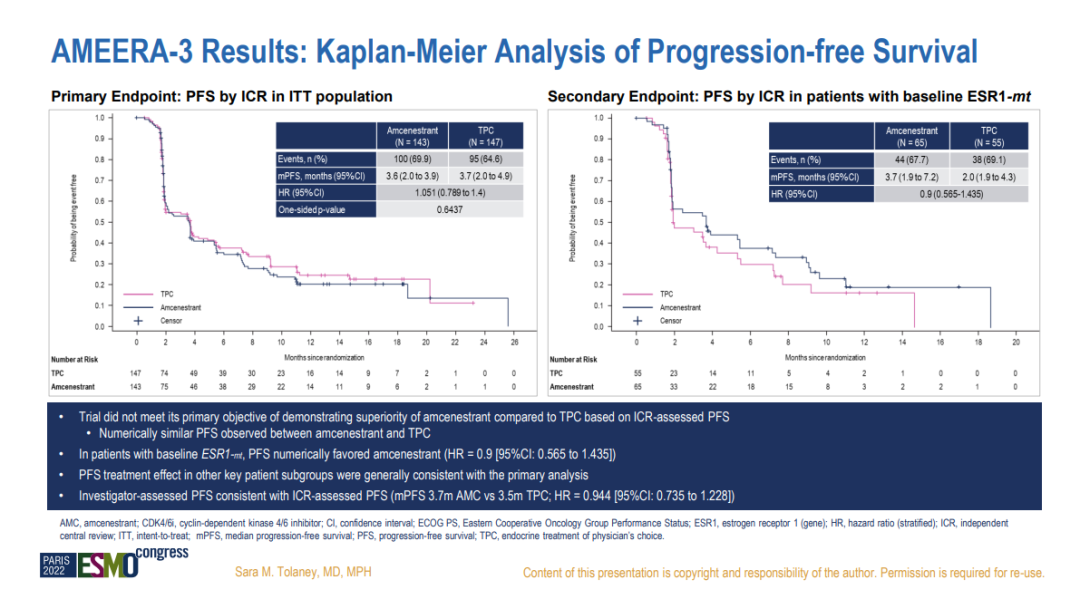
Giredestrant和amcenestrant都是本届会议上公布研究失败结局的SERD药物,但在mPFS的绝对延长时间上,giredestrant与成功的艾拉司群并未相差多少(1.8 vs 1.9m)。虽然患者基线有所差异,但绝对数值上的相似结果却出现天壤之别的结局,究竟是临床设计的因素还是患者基线的差异,亦或是对照组药物的选择分配问题,恐怕都是可以讨论的因素。
HER2:不是所有ADC,都是Enhertu

8月5日,FDA批准 Enhertu (T-DXd,DS-8201)新适应症,用于治疗无法切除或转移性HER2低表达(HER2-low)乳腺癌患者,这是首个获批用于 HER2低表达乳腺癌亚型患者的疗法,也重新定义了HER2阴性乳腺癌亚型。11日,FDA再次加速批准Enhertu用于之前接受过系统治疗的无法切除或转移性HER2突变阳性成人非小细胞肺癌(NSCLC)患者,成为FDA批准的第一个用于HER2突变阳性非小细胞肺癌的药物。Enhertu不断走向一个又一个变革路。
10. Zanidatamab zovodotin
zanidatamab zovodotin (ZW49)是Zymeworks开发的HER2靶向ADC药物,由抗体序列与ZW25相同的HER2特异性双抗通过蛋白酶可切割的缬氨酸-柠檬酸连接专有的auristatin有效载荷组成DAR为2的抗体偶联药物。
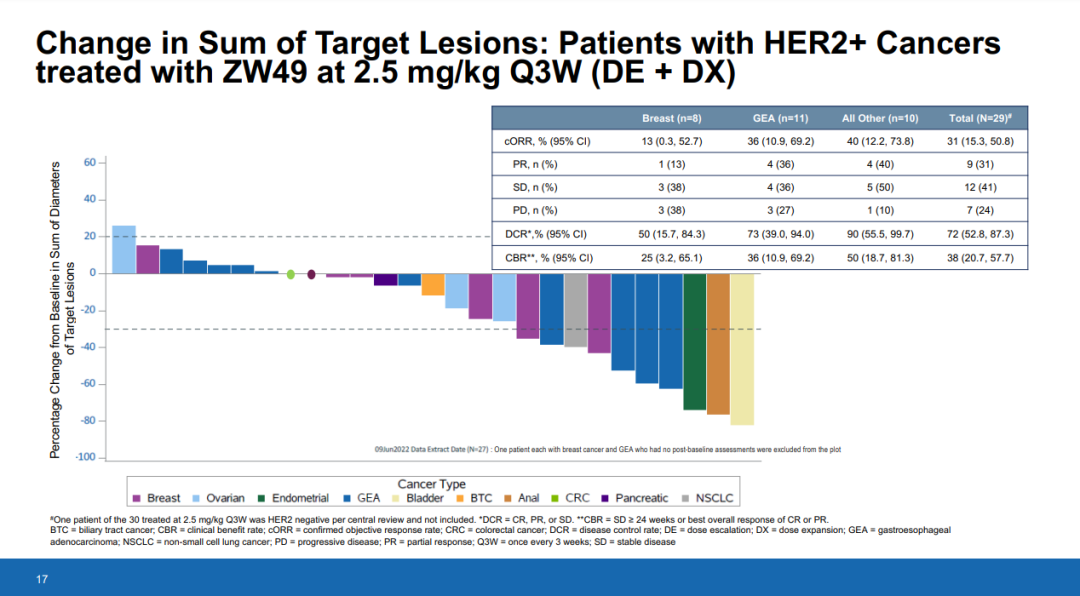
数据显示,在包括胃癌(27%)和乳腺癌(22%)等76例HER2+癌症患者的I期研究中,ZW49大多数与治疗相关的不良事件(TRAE)为1级或2级,在经历3级或更高级别TRAE的7例患者中,2例发生4级事件,包括输液相关反应和中性粒细胞计数减少;3例患者因TRAE停药,没有报告与治疗相关的患者死亡或间质性肺病病例。
在临床有效性方面,ZW49在HER2阳性乳腺癌中的ORR仅13%。这样的数据在Enhertu之后,令人怀疑ZW49迟早会被终止开发。即便这例患者先前使用了Enhertu,接受ZW49达到PR也不意味着值得在适应症中进一步开发。
目前,全球临床和上市的HER2 ADC药物多达30余款,国内自主开发和引进的就有23款。在如此众多的HER2 ADC药物中,疗效和安全性自然是衡量其临床价值的重要参考。但是,两者并不能孤立评价,抛开疗效谈安全性也就没有了任何价值。Enhertu之后,如何在临床中定位不同的HER2 ADC产品,才是最值得研究的策略。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


