盘点:2022年终盘点:HIV研究领域重要成果解读
来源:生物谷原创 2022-12-27 13:56
时至岁末,转眼间2022年已经接近尾声,迎接我们的将是崭新的2023年,在即将过去的2022年里,科学家们在艾滋病研究领域取得了多项重要的成果
时至岁末,转眼间2022年已经接近尾声,迎接我们的将是崭新的2023年,在即将过去的2022年里,科学家们在艾滋病研究领域取得了多项重要的成果,本文中,小编就对本年度科学家们在该研究领域取得的重磅级研究成果进行整理,分享给大家!
【1】Cell Rep:新发现!HIV感染或会在体内细胞中留下长期的记忆!
Larisa Dubrovsky,Beda Brichacek,N.M. Prashant,et al. Extracellular vesicles carrying HIV-1 Nef induce long-term hyperreactivity of myeloid cells,Cell Reports (2022).DOI: 10.1016/j.celrep.2022.111674
尽管抗逆转录病毒疗法已经使得HIV感染成为了一种可控的疾病,但HIV感染者经常会遭受慢性炎症的困扰,这或许就会增加其患诸如心血管疾病和神经认知功能障碍等疾病的风险,从而影响其寿命和生活质量。近日,一篇发表在国际杂志Cell Reports上题为“Extracellular vesicles carrying HIV-1 Nef induce long-term hyperreactivity of myeloid cells”的研究报告中,来自乔治华盛顿大学等机构的科学家们通过研究解释了HIV感染者机体发生慢性感染的原因,以及对机体HIV的抑制甚至剔除或许无法解决这些问题。
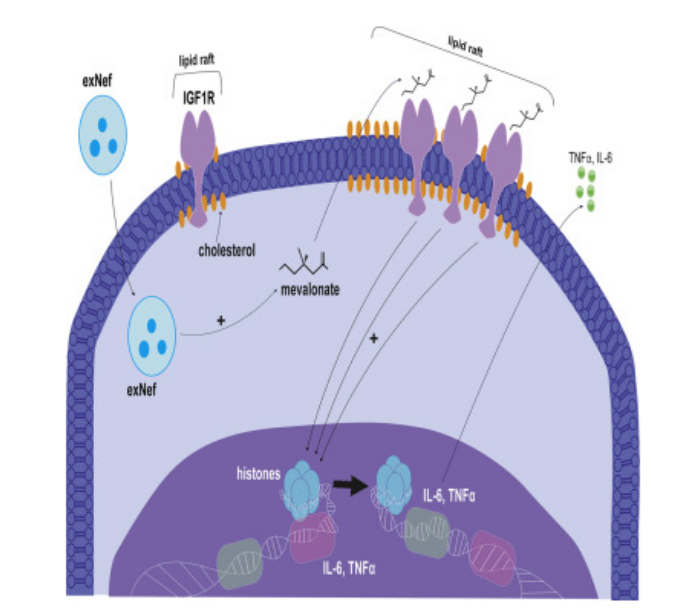
HIV感染或会在体内细胞中留下长期的记忆。
图片来源:Cell Reports (2022). DOI:10.1016/j.celrep.2022.111674
这项研究中,研究者解释了特殊的HIV蛋白如何以一种引起宿主机体免疫细胞对其它病原体过度反应的方式来永久性地改变宿主机体的免疫细胞,当这种蛋白质被引入到免疫细胞中时,细胞中与炎症相关的基因就会被开启表达,即使当HIV蛋白不在细胞中存在时,这些促炎性基因也会持续表达;研究者表示,这种原始HIV感染的“免疫学记忆”或许就是HIV感染者更容易受到长期炎症影响的原因了,这会增加其患心血管疾病和其它并发症的风险。
研究者Michael Bukrinsky教授说道,这项研究强调了临床医生和患者认识到到抑制甚至消除HIV并不会消除其出现危险疾病或并发症风险的重要性;患者和其一生仍然应该讨论如何减少其机体的炎症反应,而研究人员也应该继续深入研究寻找潜在的治疗性靶点来帮助减少HIV感染患者的机体炎症和并发症风险。
综上,本文研究结果表明,这种现象或许与细胞外Nef蛋白所诱导的“训练有素的免疫力”是一致的,其可能会导致HIV感染者在体内检测不到HIV病毒载量的情况下出现持续性的炎症和相关的共存疾病等。
【2】Nat Microbiol:识别出HIV躲避宿主机体免疫力和药物靶向作用背后的分子机制
Ishak D Irwan,Hal P Bogerd,Bryan R Cullen. Epigenetic silencing by the SMC5/6 complex mediates HIV-1 latency,Nature Microbiology (2022). doi:10.1038/s41564-022-01264-z
当病毒进入细胞并开始反转录后,未能发生整合的HIV-1前病毒就会被表观遗传化沉默,但其背后的机制,研究人员并不清楚;近日,一篇发表在国家杂志Nature Microbiology上题为“Epigenetic silencing by the SMC5/6 complex mediates HIV-1 latency”的研究报告中,来自杜克大学等机构的科学家们通过研究发现,一种可能发生进化并帮助抵御感染的机体免疫反应似乎是驱动HIV进入潜伏状态的分子机制,其潜伏在细胞中是为了重新爆发;相关研究结果或为研究人员提供了线索来揭示到底是什么样的过程能使得HIV特别隐蔽,但同时又在其它病毒感染过程中扮演着关键角色。
研究者Bryan R. Cullen博士说道,HIV感染被证明是无法治愈的,因为有少量潜伏的HIV感染的T细胞并不会被抗病毒药物和机体免疫反应所触及;这些细胞的寿命很长,且能自发地从潜伏状态出现,甚至在感染数年后才会开始产生HIV,因此患者必须终身服用抗逆转录病毒的药物。本文研究为研究者提供了重要的见解,并指出了名为SMC5/6的特殊蛋白复合体或许参与到了宿主细胞的染色体功能维持和修复过程中。
HIV进入机体后会感染免疫系统的CD4+ T细胞,随后会制造一个基因组长度的DNA分子,并整合到宿主细胞的染色体中,并在那里复制,且产生病毒RNAs和蛋白质。如果这种所谓的DNA前病毒被阻止整合到宿主细胞的DNA中(比如被一种阻断该过程的药物所阻止),那么其就无法制造出任何病毒RNAs和蛋白质,并会变得具有惰性,相反,能够进行整合的DNA前病毒通常能够驱动有成效的HIV感染。
综上,本文研究结果表明,SMC5/6复合体或许能在整合前通过表观遗传学沉默具有整合能力的HIV-1前病毒,从而在介导HIV-1潜伏期的建立中发挥着直接的作用。
【3】Cell Rep:揭示HIV-1逃避宿主机体免疫系统攻击的新机制
Jérémie Prévost,Sai Priya Anand,Jyothi Krishnaswamy Rajashekar,et al. HIV-1 Vpu restricts Fc-mediated effector functions in vivo,Cell Reports (2022). doi:10.1016/j.celrep.2022.111624
近日,一篇发表在国际杂志Cell Reports上题为“HIV-1 Vpu restricts Fc-mediated effector functions in vivo”的研究报告中,来自蒙特利尔大学等机构的科学家们通过研究发现,用来研究非中和性抗体抵御HIV功效的病毒类型或许具有关键的作用。文章中,研究人员通过对人源化小鼠进行研究首次发现,病毒蛋白Vpu的表达对于促进受感染细胞躲避机体名为抗体依赖性细胞介导的细胞毒作用(ADCC,antibody-dependent cell-mediated cytotoxicity)的消除机制至关重要。
这一机制在科学文献中已经得到了很好的记录,其能被非中和性抗体用来摆脱被病毒所感染的细胞;为了开发一种能抵御HIV-1的新型疫苗,全球很多实验室都研究产生了相同类型的抗体来预防机体感染HIV。如今,全球有数百万人都感染了HIV-1,而且其机体中拥有非中和性抗体,尽管如此,这一疾病仍然未能被有效消除,如果这些抗体能变得有效的话,为何其没有正常发挥作用呢?
研究者Finzi表示,我们观察到,在某些实验室的实验中所修饰的HIV-1并不会表达Vpu蛋白,然而,在自然发生的病毒中,该蛋白实际上在感染细胞中扮演着保镖的角色,一旦其表达的话就会允许自我复制,并通过躲避宿主机体免疫系统的监视来更好地保护自己。事实上,研究者发现,通过在受感染的细胞中表达Vpu蛋白,非中和性抗体或许就在体内很难识别这些细胞,因此,这些细胞就选择了躲避ADCC的反应。
随后研究人员通过对接受非中和性抗体的人源化小鼠进行研究证实了这一观察,相比被自然发生的病毒感染的动物而言,仅被Vpu未表达的病毒所感染的动物观察到了机体病毒载量的下降,这一观察结果与研究人员此前进行的研究得到了相互印证。早在2013年,研究者Andrés Finzi等人就通过研究发现,受感染的细胞能被保护免于ADCC反应,因为病毒的包膜在Vpu和蛋白质Nef(第二个保镖)的作用下会保持封闭状态,而在完全封闭的情况下,受感染的细胞并不会被附近的抗体所发现。综上,本文研究结果强调了Vpu蛋白所介导的逃避机体体液反应的重要性。
【4】Nat Med:科学家在治愈HIV感染目标上取得新的进展
Jesper D Gunst,Marie H Pahus,Miriam Rosás-Umbert,et al. Early intervention with 3BNC117 and romidepsin at antiretroviral treatment initiation in people with HIV-1:a phase 1b/2a, randomized trial. Nature Medicine,2022,doi:10.1038/s41591-022-02023-7.
大约40年来,全世界的科学家们一直在努力寻找治愈HIV感染的方法。近日,一篇发表在国际杂志Nature Medicine上题为“Early intervention with 3BNC117 and romidepsin at antiretroviral treatment initiation in people with HIV-1:a phase 1b/2a,randomized trial”的研究报告中,来自丹麦奥胡斯大学等机构的科学家们通过进行一项新的1b/2a期、开放标签、随机对照试验中,在这一个目标上取得新的进展。
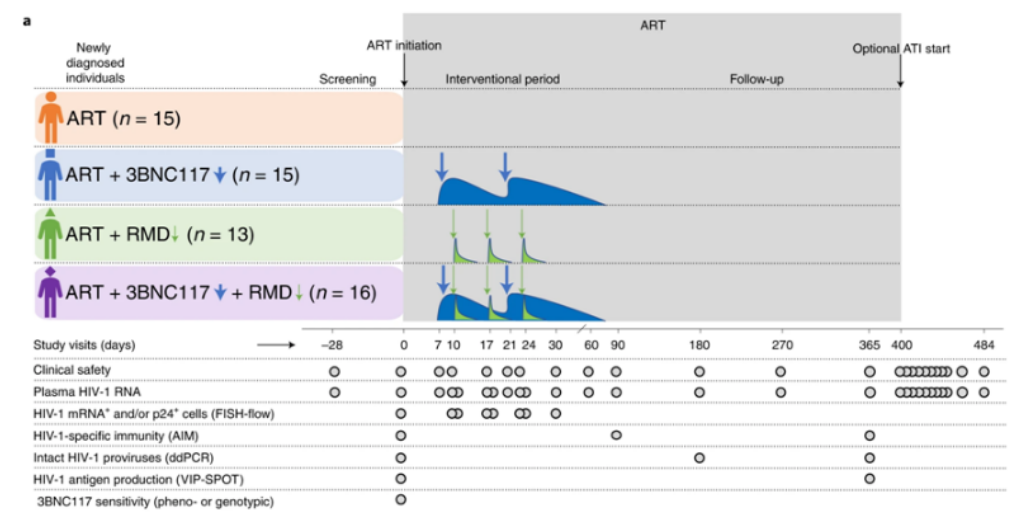
临床试验设计及参与者流程图
图片来源:Nature Medicine, 2022, doi:10.1038/s41591-022-02023-7。
来自丹麦和英国的研究参与者被随机分为四组。第一组接受了标准ART药物和实验性药物罗米地辛(Romidepsin),后者是一种组蛋白去乙酰化酶抑制剂,旨在阻止HIV隐藏在人体的免疫细胞中,而第二组接受了标准ART药物和另一种实验性药物3BNC117,后者是一种含有CD4结合位点的抗HIV单克隆抗体,有潜力消除受感染的免疫细胞并加强免疫系统。第三组仅接受标准ART药物,而第四组则接受标准ART药物和这两种类型的实验药物的组合治疗。研究者Jesper Damsgaard Gunst博士表示,这项新研究的结果非常令人鼓舞。他解释说,我们的研究表明,新诊断的HIV感染者在接受标准ART药物治疗的同时接受3BNC117抗体治疗,在治疗开始后病毒载量减少得更快,并形成了更好的抗HIV免疫力,而且如果他们暂停标准ART药物治疗,他们的免疫系统可以部分或完全抑制病毒。
在这项临床试验中,这些作者调查了在ART药物治疗开始后不久,用一种具有CD4结合位点的单克隆抗HIV-1抗体3BNC117对新诊断的HIV-1患者进行早期干预,然后用一种组蛋白去乙酰化酶抑制剂romidepsin,是否会改变HIV-1感染的进程(NCT03041012)。该试验在丹麦的五家医院和英国的两家医院进行。主要终点是分析初始病毒衰减动力学和从基线到第365天含有完整HIV-1前病毒的CD4+T细胞的频率变化。次要终点包括从基线到第365天受感染的CD4+T细胞和病毒特异性CD8+T细胞免疫力的变化、ART药物治疗前血浆HIV-1 3BNC117敏感性、安全性和耐受性以及从第400天开始的12周分析性ART药物治疗中断期间失去病毒学控制的时间。
综上所述,这些作者作出结论,在ART药物治疗开始时,3BNC117能增强血浆中HIV-1病毒和受感染免疫细胞的消除,增强HIV-1特异性CD8+免疫力,并与携带对3BNC117敏感的HIV-1毒株的个体中的持续无ART病毒学控制有关。这些发现有力地支持了在ART药物治疗启动时进行干预,作为限制HIV-1长期存在的策略。
【5】JAMA:综述文章揭示HIV感染和机体患心脏疾病之间的神秘关联!
Jonathan A. Hudson,Edith D. Majonga,Rashida A. Ferrand,et al. Association of HIV Infection With Cardiovascular Pathology Based on Advanced Cardiovascular Imaging,JAMA (2022). DOI:10.1001/jama.2022.15078
近日,一篇发表在国际杂志JAMA上题为“Association of HIV Infection With Cardiovascular Pathology Based on Advanced Cardiovascular Imaging”的综述文章中,来自英国的科学家们回顾了HIV感染和机体心肌或动脉疾病之间的关联。
这篇综述报告中,研究人员共对45项研究进行了综合性地分析和回顾,研究者表示,除了AIDS外,HIV感染者更有可能会死于其它的原因,而其主要的死亡原因或许就是心脏病了;然而,目前研究人员并未深入理解为何HIV感染者患心脏疾病的风险更高,以及是否HIV会直接影响机体的心肌或向心肌供应的动脉。
研究人员收集了所有使用先进成像技术的研究报告,旨在更好地理解HIV感染影响机体心脏健康的潜在途径,其中很多研究都来自发达国家,尽管HIV感染的全球负担主要流行于撒哈拉以南非洲地区,此外,大多数被研究的个体都是老年男性,尽管全球HIV人群中很多都是年轻女性。分析结果表明,有超过三分之一的研究都揭示了HIV感染和机体心脏动脉疾病之间的关联;然而,这些研究结果表明,这种关系的强度或许存在很大的差异;而近一半的研究也都揭示了HIV感染和心肌疾病之间的关联,但这种关系的强度也存在一定的差异。
综上,在这篇对高级心血管成像研究的系统性回顾综述中,研究人员通过对HIV感染和机体心血管疾病之间关联的评估揭示了大量的异质性,这些研究结果或许能提供现有数据的总结,但并不可能代表所有HIV感染者,包括那些来自HIV流行率较高的低收入国家的人群。
【6】eBioMedicine:肠道菌群或会促进机体对HIV感染的易感性
Jennifer A. Fulcher,Fan Li,Nicole H. Tobin,et al. Gut dysbiosis and inflammatory blood markers precede HIV with limited changes after early seroconversion,eBioMedicine (2022). doi:10.1016/j.ebiom.2022.104286
肠道微生物组的改变或许与HIV感染有关,但在横断面研究中研究人员很难确定HIV与其它因素对机体肠道微生物组的相对影响效应。近日,一篇发表在国际杂志eBioMedicine上题为“Gut dysbiosis and inflammatory blood markers precede HIV with limited changes after early seroconversion”的研究报告中,来自加州大学洛杉矶分校等机构的科学家们通过研究发现,特定的肠道菌群(包括一种对于机体健康肠道微生物组非常重要的细菌)或许在获得性HIV感染的个体与未被感染的个体中存在一定的差异。
相关研究结果表明,肠道微生物组或许会让个体处于HIV感染的风险之中,研究者Jennifer Fulcher教授说道,这是一个需要深入研究的重要领域,其或能帮助理解是否以及这些细菌如何影响HIV的传播,基于微生物组的疗法或许正在逐渐成为一个具有巨大潜力的研究领域,随着进一步的研究,其或许有望成为一种帮助预防HIV感染和传播的新方法。众所周知,慢性HIV感染和肠道细菌改变之间存在着某种关联,于是研究人员就想通过研究深入理解当HIV感染后这些改变是何时开始发生的。
为此,他们对27名男性同性恋者进行研究,在其感染HIV之前和之后收集并分析其肠道微生物组的样本,随后将研究结果与28名有类似感染行为风险但未感染HIV的男性机体的肠道微生物组样本的研究结果进行了比较;结果表明,在第一年里,受感染男性的肠道菌群几乎并未发生改变,然而随后他们发现,相比未感染的男性而言,获得性HIV感染的男性甚至在被感染之前其机体的肠道菌群就已经存在了差异。
综上,本文研究结果相比,与同一时期观察到的匹配的对照参与者相比,患有急性HIV感染的参与者机体中预先存在的微生物组或许会表现出一定差异,这些研究数据强调了增加理解微生物组在HIV易感性中所扮演角色的重要性。
【7】NEJM:基于度鲁特韦的抗逆转录病毒疗法在妊娠期更有效地抑制HIV感染
Kunjal Patel,Yanling Huo,Jennifer Jao. Dolutegravir in Pregnancy as Compared with Current HIV Regimens in the United States. NEJM,2022,doi:10.1056/NEJMoa2200600.
近日,一篇发表在国际杂志NEJM上题为“Dolutegravir in Pregnancy as Compared with Current HIV Regimens in the United States”的研究报告中,来自美国哈佛大学陈曾熙公共卫生学院的研究人员通过研究发现,基于度鲁特韦(dolutegravir)的HIV-1抗逆转录病毒疗法(ART)对孕妇来说比美国和欧洲普遍使用的其他一些ART疗法更有效。
这项新的研究显示,采用基于度鲁特韦的治疗方案的孕妇在分娩时实现病毒抑制的概率很高。在基于度鲁特韦的治疗方案和当前的其他治疗方案之间,没有观察到不良出生结果(早产、低出生体重、胎龄小或新生儿死亡)的风险差异。
研究者Kunjal Patel表示,在全球范围内,目前推荐使用基于度鲁特韦的治疗方案来治疗HIV感染,这是第一次将包括度鲁特韦的治疗方案与其他抗逆转录病毒方案---比如基于雷特格韦(raltegravir)的治疗方案---进行直接比较,这些其他的治疗方案在美国围产期指南中也被列为‘首选方案’。
度鲁特韦是最近批准的一种抗逆转录病毒药物,是每日一次治疗方案的一部分,与其他抗逆转录病毒药物相比,它被证明更有效、更容易耐受,并且不太可能在HIV-1感染者中产生新的抗药性。然而,与美国和欧洲在怀孕期间通常使用的治疗方案相比,它在怀孕期间的有效性和安全性的数据有限。
【8】Science子刊:揭示广泛中和抗体VRC07的IgG亚型影响它预防HIV传播的能力
JACQUELINE M. BRADY,MEREDITH PHELPS,SCOTT W. MACDONALD,et al. Antibody-mediated prevention of vaginal HIV transmission is dictated by IgG subclass in humanized mice. Science Translational Medicine,2022,doi:10.1126/scitranslmed.abn9662.
在HIV大流行的40多年后,科学家们对如何防御这种病毒有了新的认识,这些发现最终可能会导致产生一种中和抗体,从而在HIV成为破坏免疫力的威胁之前阻止它。近日,一篇发表在国际杂志Science Translational Medicine上题为“Antibody-mediated prevention of vaginal HIV transmission is dictated by IgG subclass in humanized mice”的研究报告中,来自美国拉根研究所等机构的科学家们通过研究破译了一种广泛保护性抗HIV抗体亚型是如何抵御HIV感染的,这一发现有朝一日可能为用基于抗体的疗法治疗或预防HIV传播的努力提供参考。
这些作者指出,一种IgG亚型抗体积极地靶向HIV包膜蛋白的保守区域。这使得这些抗体能够阻止这种病毒进入并驱动针对受感染细胞的免疫反应。研究者Jacqueline M. Brady博士表示,HIV广泛中和抗体既能阻断病毒进入,又能驱动针对遭受HIV感染的细胞的先天免疫反应。他们强调这种IgG抗体亚型触发了先天免疫系统的爆炸性活动。
先天免疫系统是指出生时就存在的防御系统,而后天免疫系统---包括B和T细胞---则是随着时间的推移而演变出来的。先天免疫系统由一系列活动组成,以多种方式提供保护。它增加了炎症反应并启动了补体级联反应,这些防御措施旨在清除体内入侵的病原体。抗HIV抗体属于IgG抗体家族,可分为四种参与不同免疫功能的亚型。然而,每种抗体亚型在抗HIV免疫中的确切作用仍不清楚。但是Brady及其同事们探究了VRC07的作用。VRC07是一种属于IgG亚型的广泛中和抗体。它也是一种实验性的HIV预防措施。
【9】Nat Med:一种新确定的生物标志物有望加快预防HIV-1感染的疫苗开发
Gilbert,P.B.,Huang,Y.,deCamp,A.C. et al. Neutralization titer biomarker for antibody-mediated prevention of HIV-1 acquisition. Nat Med 28,1924—1932 (2022). doi:10.1038/s41591-022-01953-6
广泛中和抗体(bnAb)的定义是它们能够中和多种遗传上不同的病毒毒株。近日,一篇发表在国际杂志Nature Medicin上题为“Neutralization titer biomarker for antibody-mediated prevention of HIV-1 acquisition”的研究报告中,来自华盛顿大学等研究机构的科学家们童工研究确定了一种新的生物标志物,它似乎可以有效地作为替代终点,可靠地预测广泛中和单克隆抗体防止HIV-1(导致艾滋病的最常见病毒类型)感染的能力。
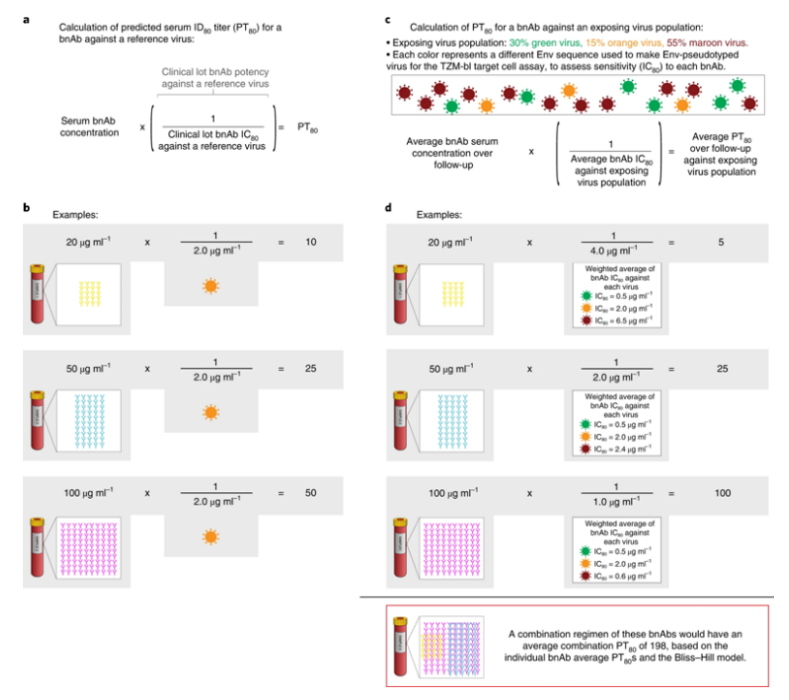
图片来源:Nature Medicine, 2022, doi:10.1038/s41591-022-01953-6。
这项新研究的结果建立在2021年3月发表的概念验证性抗体介导预防(Antibody Mediated Prevention, AMP)临床试验的基础上,该临床试验显示一种名为VRC01的bnAb能有效防止某些---但不是所有--HIV毒株的感染。在进行研究的地区---撒哈拉以南非洲、美国和南美---流行的70%的HIV毒株对VRC01有抵抗力,而且最初的报告还已指出,在整体预防HIV感染方面,VRC01组和安慰剂组之间没有统计学差异。
研究者Peter Gilbert博士表示,单一的HIV-1广泛中和单克隆抗体,如VRC01,将不足以提供对HIV-1感染的高度保护,因为许多HIV-1毒株具有抵抗性。因此,将需要bnAb混合物,尽管这些抗体有丰富的开发渠道,但我们首先需要一种生物标志物,使我们能够比较不同的bnAb混合物,并选择最佳候选混合物进行疗效试验。
Gilbert说,一种有用的生物标志物也必须被验证为替代终点,以可靠地预测HIV-1 bnAb混合物的预防功效水平。这将允许加快批准不同的HIV-1 bnAb混合物,而不需要长期和昂贵的疗效临床试验。根据这项新研究的结果,这种新确定的生物标志物---PT80---似乎符合这些要求,它可以预测bnAb受者的血液样品在特定时间对特定病毒的80%中和抗体滴度。
Lawrence Corey博士指出,换句话说,PT80定量确定了血液样本中的bnAb在特定时间点对特定HIV-1病毒毒株的‘杀伤力’。我们的研究表明,PT80很可能成为未来单克隆抗体研究中热门的生物标志物和替代终点。HVTN和HPTN期望利用这些研究结果来规划和寻求批准AMP临床试验之后的大规模疗效研究。
【10】PNAS:首次解析出HIV-1基质的原子视图,有助于揭示这种病毒组装和包膜蛋白整合机制
Alexandra B. Samal,Todd J. Green,Jamil S. Saad,et al. Atomic view of the HIV-1 matrix lattice; implications on virus assembly and envelope incorporation. PNAS,2022,doi:10.1073/pnas.2200794119.
导致艾滋病的HIV-1的组装发生在受感染细胞的内质膜层上,这是一个几何构建过程,在病毒蛋白Gag的N端基质结构域(matrix domain,MA)的引导下,从病毒Gag蛋白的三聚体中产生六聚体。然而,四十年来一直缺乏这种病毒颗粒组装的某些细节。近日,一篇发表在国际杂志PNAS上题为“Atomic view of the HIV-1 matrix lattice;implications on virus assembly and envelope incorporation”的研究报告中,来自阿拉巴马大学伯明翰分校等机构的科学家们通过研究提供了HIV-1基质晶格的首个原子视图,以2.1埃的分辨率显示了它的分子细节,这一发现推进了对病毒组装和病毒包膜蛋白(Env)整合的关键机制的理解。
研究者表示,我们的发现可能有助于开发新的治疗药物,以抑制HIV-1组装、包膜整合和最终的病毒产生。Gag蛋白经过翻译后修饰,在此过程中加入了一个类似脂质的豆蔻酸基团(myristate),以帮助Gag与质膜结合。在此之前,Gag的豆蔻化基质结构域(myristoylated matrix domain, myrMA)是如何组装成晶格的,仍然是未知的。低分子分辨率的技术---比如低温电子衍射和低温电子断层扫描---表明myrMA蛋白组装为三聚体,然后这些三聚体经历高阶组装,形成六聚体。Saad的研究与近期的一项研究的结果一致,即myrMA蛋白经历了巨大的结构变化,以便在未成熟和成熟的病毒颗粒中形成不同的六聚体晶格。病毒成熟是病毒复制周期的最后一步,因为在组装好的病毒内形成了包膜核心,从而产生了具有传染性的病毒颗粒。
总之,我们为HIV-1 myrMA晶格提供了一个原子视图,揭示了关于myrMA亚基、三聚体、三聚体-三聚体界面、myr交换、MA突变对myrMA结构的影响以及由此形成的晶格的缺陷的宝贵结构见解。我们的数据还支持在病毒组装和成熟过程中交替出现的MA-PI(4,5)P2结合机制。这些发现填补了我们对Gag在质膜上的组装和Env整合到病毒颗粒中的机制的一个主要空白。
【11】PNAS:利用超级计算机揭示HIV-1衣壳上的漏洞
Alvin Yu,Elizabeth M. Y. Lee,John A. G. Briggs,et al. Strain and rupture of HIV-1 capsids during uncoating. PNAS,2022,doi:10.1073/pnas.2117781119.
关于HIV-1病毒如何感染我们的细胞,仍有许多东西有待发现。科学家们知道,它避开了我们免疫系统的防御,进入白细胞以递送它的基因负荷(genetic payload)并劫持细胞的转录复合物,进而产生病毒RNA的拷贝和新的HIV-1病毒。但许多细节仍然模糊不清。2021年的一项重大实验发现为这个谜团带来了一些曙光,并发现这种病毒的衣壳,即一种保护它的RNA基因组的蛋白包膜,在进入目标细胞的细胞核时一直保持完整。最后,这种病毒衣壳必须保持足够长的稳定性,以便将它的致命的基因货物带入细胞核。但是最终,它必须破裂以释放它的遗传物质。科学家们还不知道的是,HIV-1病毒的外壳如何以及为何会变得不稳定。
近日,一篇发表在国际杂志PNAS上题为“Strain and rupture of HIV-1 capsids during uncoating”的研究报告中,来自美国德克萨斯大学奥斯汀分校等机构的科学家们通过研究进一步加深了科学家们对HIV-1病毒如何感染的理解,并协助生成了第一个关于它的衣壳的现实模拟,包括它蛋白、水、遗传物质和最近发现的一种叫做IP6的关键辅助因子,该辅助因子稳定和帮助形成这种衣壳。
研究者表示,这些非常大的模拟和我们所做的分析揭示了HIV-1病毒衣壳盔甲的漏洞。研究者Voth及其同事们利用从马克斯-普朗克生物化学研究所细胞与病毒结构系的John Brigg博士的实验室获得的实际病毒的低温电子断层扫描数据开始研究。利用这些实验数据,他们开发了一种HIV-1病毒衣壳的全原子分子动力学模拟,接近1亿个原子。
这项新研究中的模拟图片显示了这种病毒衣壳上的条纹,这表明存在应力-应变(stress-strain)。它们准确地指出了这种衣壳上的蛋白晶格发生压缩或膨胀的位置,并且在经历痛苦的应变,这告诉科学家们这种应力-应变并不是完美分布的。
【12】Nat Biotechnol:一种新型技术或仅需通过单次注射就能治疗HIV感染
Nahmad,A.D.,Lazzarotto,C.R.,Zelikson,N. et al. In vivo engineered B cells secrete high titers of broadly neutralizing anti-HIV antibodies in mice. Nat Biotechnol (2022).doi:10.1038/s41587-022-01328-9
近日,一篇发表在国际杂志Nature Biotechnology上题为“In vivo engineered B cells secrete high titers of broadly neutralizing anti-HIV antibodies in mice”的研究报告中,来自以色列特拉维夫大学等机构的科学家们通过研究开发了一种新型独特的AIDS疗法,其或能被开发成为疫苗或对HIV患者进行一次性治疗。本文研究中,研究人员分析了如何工程化改造患者机体中的B细胞,从而促使其分泌抗HIV抗体来应对病毒的感染。
在过去20年里,由于实施了将这种致死性疾病转化为慢性疾病的治疗性手段,很多AIDS患者的生活得到了明显改善,然而,在找到能为患者提供永久性治愈的治疗方法之前,科学家们或许还有很长的一段路要走,其中一种可能性的方法就是进行一次性注射,这种策略是在Barzel博士的实验室中开发的,其所开发的技术能对患者体内的B细胞进行遗传工程化改造来使其分泌能抵御HIV病毒的中和性抗体。B细胞是一类负责产生抵御病毒等微生物的抗体的白细胞,其主要产生自骨髓中,当其成熟时B细胞能进入血液和淋巴系统中,并从这些位点达到机体不同部位。
研究者Barzel解释道,直到现在仅有少数科学家能在体外对B细胞进行工程化改造,这项研究中我们首次在体内对其改造并使得这些细胞能产生所想要的抗体,这种基因工程技术是利用源自病毒的病毒载体来完成的,这些病毒会被设计成为不会对机体造成损伤,而只是将编码抗体的基因带入机体的B细胞中。此外,在这种情况下,研究人员就能准确地将抗体引入到B细胞基因组的理想位点中,所有接受疗法的动物模型都会产生反应且机体中含有大量的所需抗体,研究人员从血液中产生了抗体并且确保其能有效中和培养皿中的HIV病毒。
此外,如果病毒发生变化,B细胞就会相应地发生改变从而来抵御病毒,这样研究中,研究人员创造了有史以来第一种能在机体中进化并在军备竞赛中击败病毒的药物,研究人员预计在未来几年将会以这种方式生产出更多治疗AIDS等多种疾病的新型药物疗法。
【13】Nature:两种广泛中和抗体组合使用可长时间抑制HIV
Sneller,M.C.,Blazkova,J.,Justement,J.S. et al. Combination anti-HIV antibodies provide sustained virological suppression.Nature 606,375–381 (2022).doi:10.1038/s41586-022-04797-9
近日,一篇发表在国际杂志Nature上题为“Combination anti-HIV antibodies provide sustained virological suppression”的研究报告中,来自美国国家过敏症与传染病研究所等机构的科学家们通过研究发现,在感染早期就开始接受抗逆转录病毒疗法(ART)的HIV感染者在接受了两种广泛中和抗HIV抗体(bNAb)注射之后,在没有接受ART治疗的情况下实现了长时间的HIV抑制。这些研究结果表明在未来联合bNAb疗法可能为HIV感染者提供了一种日常ART的替代方案。
尽管口服抗逆转录病毒药物在控制HIV水平方面非常有效,但是对一些HIV感染者来说,坚持每天服药可能是困难的。此外,这些药物可能会因终身使用而产生长期的副作用,并为耐药性病毒的产生提供了可能性。在之前的研究中,单一的bNAb在抑制HIV病毒水平方面只显示出有限的成功,部分原因是抵抗bNAb的HIV要么已经存在,要么在个体身上出现。为了解决这个问题,这些作者测试了两种bNAb---3BNC117和10-1074---的联合使用(下称3BNC117/10-1074),它们靶向HIV表面的不同部分。
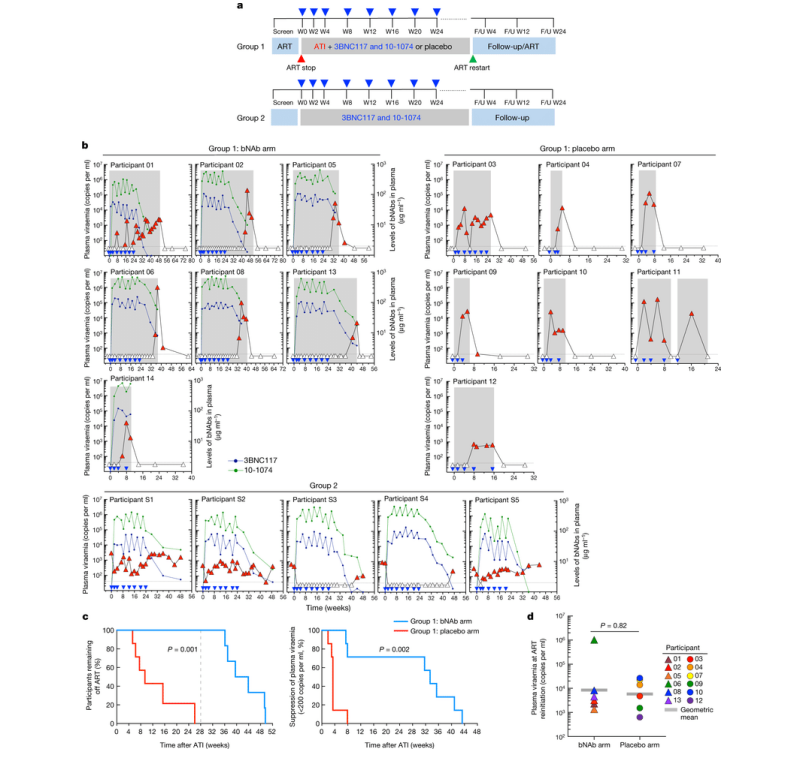
图片来源:Nature 606,375–381 (2022).doi:10.1038/s41586-022-04797-9
这些作者在2018年9月至2021年1月期间进行了一项由两部分组成的临床试验。第一部分是一项1期随机、安慰剂对照临床试验,涉及14名HIV参与者。这些参与者在感染的早期阶段开始了ART治疗,而且在第一次注射3BNC117/10-1074或安慰剂后不久就停止了ART治疗。这些参与者接受了最多八次3BNC117/10-1074或安慰剂的注射---第一个月两次,此后每月一次,为期24周。每两周测量一次HIV病毒水平和CD4+ T细胞计数。
这项新研究的目的是看看在没有ART治疗的情况下,3BNC117/10-1074治疗是否能抑制HIV。在接受3BNC117/10-1074治疗的7名参与者中,没有人在注射后28周之前重新开始ART治疗,相比之下,在接受安慰剂的7名参与者中,有6人重新开始ART治疗。停用ART治疗的时间中位数分别为39.6周(3BNC117/10-1074治疗组)和9.4周(安慰剂对照组)。
【14】Nature:科学家发现抗HIV-1抗体治疗可抑制病毒感染
Gaebler,C.,Nogueira,L.,Stoffel,E. et al. Prolonged viral suppression with anti-HIV-1 antibody therapy. Nature (2022).doi:10.1038/s41586-022-04597-1
HIV-1感染仍然是一个无法治愈的公共卫生问题。抗逆转录病毒疗法(ART)在抑制病毒复制和预防疾病进展方面非常有效,但由于潜伏前病毒库稳定地整合到CD4 T细胞基因组中,因此需要终身药物管理。在没有抗逆转录病毒治疗的情况下,向人类施用抗HIV-1广泛中和抗体(bNAbs)是安全的,并且能够有效地预防感染,降低病毒血症和维持抗体敏感病毒的病毒抑制。有人提出,广泛中和抗体可以作为ART的辅助药物,或作为旨在诱导长期无ARTHIV-1缓解的独立维持治疗。近日,一篇发表在国际杂志Nature上题为“Prolonged viral suppression with anti-HIV-1 antibody therapy”的研究报告中,来自洛克菲勒大学的科学家们通过研究评估了重复bNAb联合治疗维持长期病毒抑制的有效性及其对HIV感染者潜伏病毒库的大小和组成的影响。
在本研究中,研究人员进行了一项临床研究,其中HIV感染者在存在或不存在ART的情况下,在20周内接受了七剂两种广泛中和抗体3BNC117和10-1074的组合,对其安全性、耐受性和抗病毒活性进行了研究。
研究发现,3BNC117和10-1074的药代动力学特征在病毒抑制期间与同时存在的抗逆转录病毒药物无关,并且在20周内多次给药后不会改变。在没有预先筛查抗体敏感性的情况下,17名(76%)可评估的1组受试者中有13名在ART停用后至少20周内保持病毒抑制。在第20周后仍然受到抑制的个体中,反弹时3BNC117和10-1074的平均血清浓度分别为3.5和28.3μg·ml-1。为了检查病毒单克隆抗体敏感性测试对病毒反弹时间的潜在影响,研究人员对储库和血浆反弹病毒进行了事后分析。研究发现,事后敏感性分析并不能预测病毒反弹的时间。在病毒被抑制20周以上的个体中,当其中一种抗体的血清浓度达到10μg·ml-1以下时,会出现反弹的病毒血症。在接受所有七个抗体剂量的人中,有两个人在一年后保持了抑制。抗体治疗6个月后进行的储库分析显示完整的前病毒储库的大小和组成发生了变化。相比之下,这些人的缺陷库没有明显的减少。
综上,这些数据表明,抗体给药会影响HIV-1储库,但还需要更多更大规模和更长时间的研究来确定抗体免疫疗法对储库的确切影响。
【15】PLoS Pathog:为何即使进行了抗逆转录病毒疗法HIV仍能在人类组织中长期存留?
Shima Shahbaz,Isobel Okoye,Gregg Blevins,et al. Elevated ATP via enhanced miRNA-30b, 30c,and 30e downregulates the expression of CD73 in CD8+ T cells of HIV-infected individuals, PLoS Pathogens (2022). doi:10.1371/journal.ppat.1010378
在抗逆转录病毒疗法的帮助下,HIV的感染不再是人类曾经的生命判决,但尽管控制和治疗该病毒引起的AIDS的药物非常有效,但或许HIV永远无法从机体中被完全清除,HIV仍然会在不同的人体组织深处的一些细胞中“徘徊”,而宿主机体的免疫系统并不会注意到它。近日,一篇发表在国际杂志PLoS Pathogens上题为“Elevated ATP via enhanced miRNA-30b, 30c, and 30e downregulates the expression of CD73 in CD8+ T cells of HIV-infected individuals”的研究报告中,来自阿尔伯塔大学等机构的科学家们通过研究揭示了为何受感染的人类仍然无法完全摆脱HIV。
文章中,研究者发现,在HIV患者机体中,杀伤性T细胞很少甚至并不会携带CD73蛋白质,杀伤性T细胞是一类主要负责识别并破坏被病毒感染的细胞的白细胞。由于CD73主要负责细胞的迁移以及移动到组织中,缺少该蛋白或许就会损伤杀伤性T细胞寻找并消除HIV感染细胞的能力。这种机制或许就解释了为何HIV会永远停留在人体组织中的一个潜在原因,这项研究还揭示了HIV感染的复杂性。
经过广泛的研究,研究者发现,慢性炎症或许会导致机体细胞和血液中特殊类型RNA水平的增加,即microRNAs的水平发生了增加,这是一种非常小的RNA类型,其能与信使RNAs结合并阻断其制造CD73蛋白,这或许就是导致CD73基因表达被抑制的原因。本文研究发现或能帮助解释为何HIV感染者患多发性硬化症的风险较低。研究者指出,CD73的减少或消除对于保护HIV感染者抵御多发性硬化症而言非常有益,因此,靶向作用CD73或许是多发性硬化症患者的一种新型潜在的治疗性标志物。
综上,本文研究结果或能部分解释为何HIV感染者考虑到CD73在T细胞有效进入中枢神经系统中的作用而降低机体患多发性硬化症的风险。
【16】Cell:揭示完整HIV病毒颗粒上的Env蛋白三维结构 或有望揭示Gag晶格的结构变异和定位
Vidya Mangala Prasad,Daniel P. Leaman,Klaus N. Lovendahl,et al. Cryo-ET of Env on intact HIV virions reveals structural variation and positioning on the Gag lattice. Cell,2022,doi:10.1016/j.cell.2022.01.013.
近日,一篇发表在国际杂志Cell上题为“Cryo-ET of Env on intact HIV virions reveals structural variation and positioning on the Gag lattice”的研究报告中,来自华盛顿大学等机构的科学家们通过利用在结构生物学领域开发的强大工具和技术,发现了有关人类免疫缺陷病毒(HIV)的新细节。这些发现使人们关注这种病毒表面上下的基本结构,可能有助于设计和开发预防艾滋病(AIDS)的疫苗。
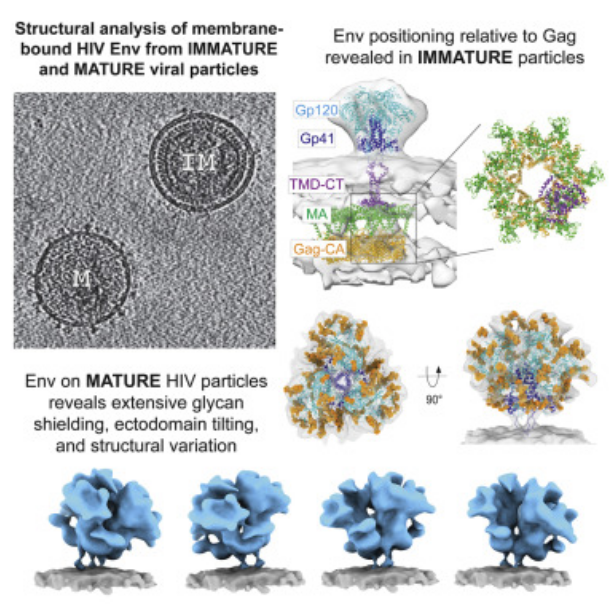
图片来源:Cell, 2022, doi:10.1016/j.cell.2022.01.013
这些详细的发现包括在整个HIV病毒的背景下,这种病毒的包膜“刺突”蛋白(Env蛋白,在这种病毒与宿主细胞结合时使用)的结构和位置的三维视图。通常情况下,科学家们会观察从这种病毒中分离出来的蛋白颗粒,或者表达为工程蛋白或纯化蛋白。在另一项关键的发现中,这些作者对聚糖屏障(glycan shield)有了新的认识---病毒蛋白表面上存在的可以将HIV隐藏在身体免疫系统之外的糖链。
研究者Kelly Lee博士表示,我们正在研究整个HIV病毒颗粒,以及这种病毒表面上的Env蛋白与该病毒的其他部分有什么联系。通过观察完整的病毒结构,我们可以观察到这个“病毒脸部”的不同面是如何显示的,以及它们将如何被免疫系统识别或隐藏。
针对HIV病毒表面上的包膜刺突蛋白相对于该病毒内部蛋白结构(称为Gag晶格)的定位,这种完整的HIV病毒视图还使得这些作者获得了新的见解。Lee说,“这一发现推翻了以前关于这种病毒各部分如何组装的模型,并有助于将我们的注意力集中在这两种蛋白的对接互动可能在哪里发生。这种对接互动需要更详细地解析出,但这项新的研究至少给我们提供了这种病毒组装的正确架构模型。”
【17】Nat Commun:开发高效HIV疫苗有戏!天然样env三聚体在体内产生对抗HIV的Tier-2中和抗体
Xu, Z.,Walker,S.,Wise,M.C. et al. Induction of tier-2 neutralizing antibodies in mice with a DNA-encoded HIV envelope native like trimer. Nat Commun 13,695 (2022). doi:10.1038/s41467-022-28363-z
在发现HIV病毒近40年后,它已经杀死了3630万人,但迄今为止仍然没有有效的疫苗问世。近日,一篇发表在国际杂志Nature Communications上题为“Induction of tier-2 neutralizing antibodies in mice with a DNA-encoded HIV envelope native like trimer”的研究报告中,来自美国威斯达研究所的研究人员在开发HIV疫苗的方向上迈出了充满希望的一步。他们首次证实了使用一种独特的天然样env三聚体(native-like trimer,即类似于天然env三聚体的三聚体)在小鼠中产生对对抗HIV非常重要的Tier-2中和抗体的前景。
文章中,研究人员将这种天然样env三聚体编码到DNA中,以便递送到小鼠体内。这有一个实际的好处,就是把宿主的身体变成了“抗原工厂”,而不是需要一个复杂的疫苗制造过程。他们随后比较了给予DNA编码的天然样env三聚体的小鼠和接受标准蛋白免疫的小鼠的结果。只有那些接受了DNA编码的本天然样env三聚体的小鼠产生了Tier-2中和抗体。研究者Kulp表示,我们能够用两种平台产生强烈的免疫反应,但是这种DNA平台独特地推动了这种中和反应。
一旦他们验证了他们的免疫方案产生了Tier-2中和抗体,Kulp和他的同事们从这些小鼠身上分离出单克隆抗体,并使用低温电镜来确定一种Tier-2中和单克隆抗体的原子结构。他们发现,该抗体与一个名为C3V5的表位结合。在标准HIV疫苗模型(非人类灵长类动物)中,先前的研究已表明与C3V5结合的抗体可以保护这些动物免受SHIV感染,其中SHIV感染非人类灵长类动物,是HIV的近亲。
研究者指出,这种结构让我们对这种抗体如何能够中和这种病毒有了难以置信的了解。我们首次可以就如何设计能够产生针对C3V5表位的广泛中和抗体反应的新疫苗制定策略。
【18】Nat Med: IL-15超级激动剂N-803对HIV感染者是安全的和有效的
Miller,J.S.,Davis,Z.B.,Helgeson,E. et al. Safety and virologic impact of the IL-15 superagonist N-803 in people living with HIV:a phase 1 trial. Nat Med 28,392–400 (2022). doi:10.1038/s41591-021-01651-9
近日,一篇发表在国际杂志Nature Medicine上题为“Safety and virologic impact of the IL-15 superagonist N-803 in people living with HIV: a phase 1 trial” 的研究报告中,来自美国明尼苏达大学的科学家们通过进行一项1期临床试验,证实了一种新型免疫治疗药物(N-803)在治疗HIV病毒感染方面的安全性和有效性。
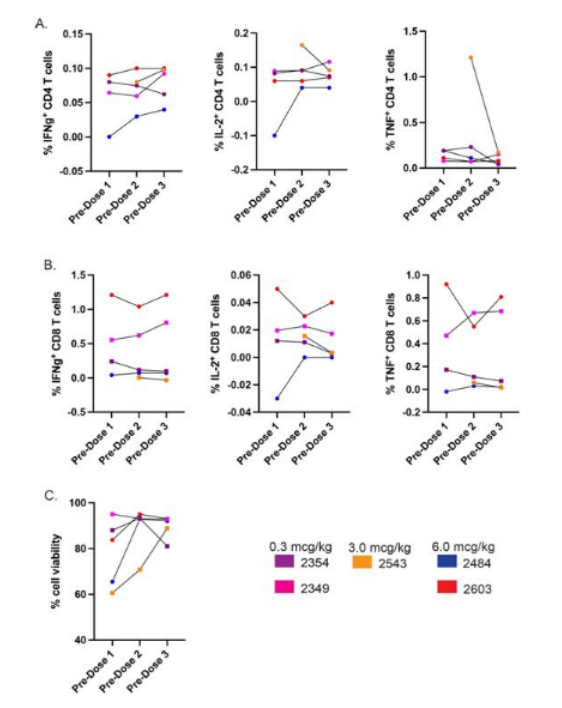
N-803刺激后细胞活力和细胞因子释放
图片来源:Nature Medicine, 2022, doi:10.1038/s41591-021-01651-9
研究者Tim Schacker博士指出,我们对这项初步临床试验所显示的前景感到兴奋。我们希望将这项研究工作推进到2期临床试验,以便我们最终能够为那些HIV感染者增加一种有希望的治疗方法。这项临床试验涉及一种已在血癌和其他肿瘤中进行过研究的新型实验性药物—IL-15超级激动剂N-803。N-803由一个发生N72D突变的IL-15分子连接到它的α受体和一个增加IL-15活性的人类IgG1片段组成。这是该药物首次在HIV患者身上进行测试。
在明尼苏达大学开启的这项1期临床试验招募了16名参与者,他们被要求接受抗逆转录病毒疗法(ART)至少一年时间。在这些参与者中,有11人完成了这项临床试验,不良反应很小,这表明对接受ART治疗的HIV患者使用N-803是安全的。虽然不是这项临床试验的主要目标,但是使用N-803的参与者在治疗后长达6个月的时间里,血液中的HIV感染细胞明显减少。
【19】Science子刊:揭示癌症免疫治疗药物派姆单抗或能逆转HIV的潜伏
THOMAS S. ULDRICK,SCOTT V. ADAMS,REMI FROMENTIN,et al. Pembrolizumab Induces HIV Latency Reversal in People Living with HIV and Cancer on Antiretroviral Therapy. Science Translational Medicine,2022,doi:10.1126/scitranslmed.abl3836.
近日,一篇发表在国际杂志Science Translational Medicine上题为“Pembrolizumab induces HIV latency reversal in people living with HIV and cancer on antiretroviral therapy”的研究报告中,来自国外的科学家们通过研究发现,癌症免疫治疗药物派姆单抗(pembrolizumab)或能能够逆转HIV潜伏,即这种病毒在接受抗逆转录病毒疗法的HIV感染者的细胞内“潜伏”的能力,这是治愈HIV的主要障碍。
派姆单抗可以逆转免疫系统的“衰竭”。具体来说,当杀伤性T细胞精疲力尽时,它们在它们的表面会表达一些蛋白,其中之一是PD1。抗PD-1抗体通过阻断这种衰竭标志物发挥作用,使杀伤性T细胞恢复功能并杀死癌症。这种药物已经彻底改变了包括黑色素瘤在内的几种癌症的治疗。就HIV而言,之前由墨尔本大学彼得-多尔蒂感染与免疫研究所主任Sharon Lewin教授和她的团队进行的研究已发现衰竭标志物PD1允许HIV进入潜伏状态。
如今,这项新的临床研究是对派姆单抗在同时感染HIV的癌症患者中进行的最大的、多中心的前瞻性临床试验。Lewin教授说,到目前为止,只有病例报告显示抗PD-1的效果,因为HIV感染者也需要这种药物治疗他们的癌症是非常罕见的。
Lewin教授解释道将这种方法应用于没有癌症的HIV感染者并不是一件容易的事情。目前免疫疗法的副作用很大,例如,有5%到10%的人会出现不良反应。在癌症中,这不是一个主要的问题,因为你患有威胁生命的疾病,但在HIV感染中,情况非常不同。人们如今可以携带HIV的情形下过着正常和健康的生活,因此任何用于治愈的干预措施都必须具有非常低的毒性。在这项研究中,我们能够发现在一个由32名同时感染HIV的癌症患者组成的队列中,派姆单抗能够扰乱HIV病毒库,这是一个非常令人兴奋的结果,并涉及到世界各地的许多团体。
【20】Science子刊:精英控制者对HIV的清除性治愈可能隐藏着终结艾滋病的秘密
XIAODONG LIAN,CE GAO,XIAOMING SUN,et al. Signatures of immune selection in intact and defective proviruses distinguish HIV-1 elite controllers. Science Translational Medicine, 2021,doi:10.1126/scitranslmed.abl4097.
一些经诊断感染HIV病毒的患者能够在没有接受抗逆转录病毒药物甚至干细胞移植的情况下根除这种病毒,拥有天然抑制这种病毒的能力,实现了医学上可验证的治愈。科学家们称这一小群人为精英控制者(elite controller),这一称呼反映了他们拥有控制HIV的独特能力。最近几个月,这类患者中有两个人在科学文献中获得了声誉,每个人都有一个代号:一个称为旧金山患者(San Francisco Patient),另一个称为埃斯佩兰萨患者(Esperanza Patient)。这两人都是因从体内根除HIV而受到关注的女性。
除了这两个著名的例子之外,来自美国拉根研究所的研究人员在一项新的研究中将注意力集中在一个更大的精英控制群体(共58人)上,这些人凭借其独特的生物能力也能够控制住这种病毒。这些精英控制者与42名接受抗逆转录病毒药物(ART)治疗的HIV患者进行了比较,这42名患者在不接受ART治疗的情形下不能控制这种病毒,可作为全球绝大部分HIV感染者的代表。相关研究结果"Signatures of immune selection in intact and defective proviruses distinguish HIV-1 elite controllers”发表在Science Translational Medicine杂志上。
这些作者发现了一个表明精英控制者具有根除这种病毒的不寻常能力的新线索。一个原因是强大的免疫反应,但另一个原因是病毒基因序列潜伏在人类基因组中的位置。这些序列往往嵌入到较为偏远的染色体中,在那里它们不太可能复制,但更有可能被免疫力量发现。这项研究为了解感染HIV意味着什么打开了一扇新的窗口。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


