JCB: 去泛素化酶调节膜蛋白的生物合成
来源:本站原创 2021-04-11 02:00
许多具有疏水跨膜结构域(TMD)的蛋白质能够在翻译生成之后从细胞质向细胞膜中转移,然而,目前尚不清楚疏水性膜蛋白如何逃避胞质蛋白质量控制(PQC)的识别。此前研究发现,该质控程序通常可识别错误折叠的蛋白的疏水性结构,并通过添加泛素链将其标记为蛋白酶体进入降解环节。
2021年4月11日讯/生物谷BIOON/---许多具有疏水跨膜结构域(TMD)的蛋白质能够在翻译生成之后从细胞质向细胞膜中转移,然而,目前尚不清楚疏水性膜蛋白如何逃避胞质蛋白质量控制(PQC)的识别。此前研究发现,该质控程序通常可识别错误折叠的蛋白的疏水性结构,并通过添加泛素链将其标记为蛋白酶体进入降解环节。
(图片来源:JCB,Rockfeller University Press)
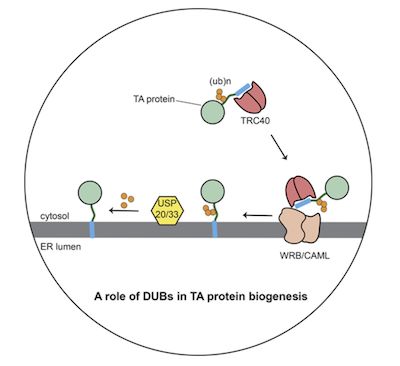
在最近发表在《Journal of Cell Biology》杂志上的一项研究中,来自耶鲁大学的Malaiyalam Mariappan团队发现:尾锚(TA)蛋白可被胞质PQC识别,并在细胞中合成后立即泛素化。出人意料的是,泛素化的TA蛋白没有进一步进入蛋白酶体降解,而是被转移至TRC40附近,并被递送至ER进行插入。 ER相关的去泛素酶USP20和USP33在将TA蛋白质插入ER后将其去除。因此,这一结果表明:去泛素酶能够挽救调节膜蛋白被被胞质中PQC识别并降解的命运,从而正确地向细胞膜转移。

(TA蛋白在细胞质中被泛素化)
蛋白内质网插入途径的标志是跨膜结构域(TMD)的合成和在ER膜上的耦合,从而避免了TMD暴露于细胞质中。然而,许多具有疏水性C末端TMD的新生TA蛋白首先被释放到细胞质中,进而插入细胞膜中。细胞质内存在广泛的PQC网络,该网络通常会识别错误折叠或定位错误的蛋白质中暴露出的疏水性结构,并通过添加泛素链将其标记为蛋白酶体降解。因此,作者试图研究细胞如何区分哪些蛋白质进入降解程序,而另外一些进入细胞膜插入程序。

(图2,TA蛋白接受去泛素化并被插入内质网膜中)
作者假设,如果TA蛋白不受细胞质PQC机制的影响,那么它们不应在细胞中被泛素化和降解。为了测试这一点,我们构建了在其C末端TMD的疏水性方面有所不同的TA蛋白。首先,作者检查了新合成的TA蛋白在靶向和插入ER膜之前是否在细胞质中泛素化。结果显示,TA蛋白Sec61 translocon的组成部分Sec61β的体外翻译产生与Sec61β泛素化一致的修饰,与先前的研究相符。泛素化取决于TMD,因为将其去除会导致泛素化的明显损失。然而尽管依赖于TMD,泛素化仅发生在Sec61β,因为TMD缺少赖氨酸残基接受泛素化。
进一步,作者对蛋白质泛素化的细节进行了探究。结果显示:TA蛋白质携带K48泛素化标签,表明其最终的命运可能进入蛋白酶体进行降解。在此基础上,作者发现TA蛋白的泛素化过程不依赖于细胞靶向因子的局限性。之后,作者发现泛素化的TA蛋白在内质网附着,并且进一步接受内质网表面的USP20以及USP33的去泛素化。去泛素化过程与内质网插入过程均在该区域完成。
综上,作者揭示了具有疏水性结构域的蛋白质在细胞质中如何顺利转移到细胞膜上,而不被泛素化降解的分子机制。(生物谷 Bioon.com)
原始出处:Jacob A. Culver, Malaiyalam Mariappan; Deubiquitinases USP20/33 promote the biogenesis of tail-anchored membrane proteins. J Cell Biol 3 May 2021; 220 (5): e202004086. doi: https://doi.org/10.1083/jcb.202004086
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


