BMC子刊:填补空白!北京安定医院团队揭示艾司西酞普兰与肠道微生物之间的互作,并发现微生物的孢子基因可以预测治疗效果
来源:网络 2023-09-08 14:55
目前,选择性5-羟色胺再摄取抑制剂(SSRI)是重度抑郁症(MDD)的一线治疗选择,但仅有约1/3的患者能够获得缓解[1,2]。患者对药物响应和缓解程度的异质性受到多种因素影响,了解这些因素是改善MD
目前,选择性5-羟色胺再摄取抑制剂(SSRI)是重度抑郁症(MDD)的一线治疗选择,但仅有约1/3的患者能够获得缓解[1,2]。患者对药物响应和缓解程度的异质性受到多种因素影响,了解这些因素是改善MDD治疗和预后所必需的。
在多种疾病的药物治疗中,肠道微生物的影响逐渐被大家所重视,近年来的人类和动物研究表明,抗抑郁药物对肠道微生物具有调节作用,反之,肠道微生物也可以通过化学修饰和改变药物的生物利用度、生物活性或毒性来影响个体对药物的响应[3,4]。
此前的研究缺少较大规模的患者数据,并且集中在单一组学变化上。为此,首都医科大学附属北京安定医院的王刚教授和杨健研究员领导的研究团队,对110例MDD患者的粪便和血浆样本进行了纵向多组学分析,以阐明一种SSRI艾司西酞普兰(ESC)对肠道微生物的影响以及肠道微生物和ESC疗效之间的关系。
他们发现,ESC可以改善MDD的异常血液代谢,对肠道微生物具有相对较弱的抑制作用,导致微生物多样性和功能的下降。肠道微生物可能通过改善3-吲哚丙酸等血液代谢物影响抑郁症状,治疗前微生物多样性高的患者更有可能达到临床缓解,以及治疗前的肠道微生物孢子基因对抑郁症状缓解具有良好的预测效果(AUC=0.71)。
研究结果发表在Microbiome杂志上[5]。

研究人员从一个大型队列中筛选了110例接受ESC单药治疗的MDD患者,同时匹配了166例健康人对照。在治疗12周后,患者的17项汉密尔顿抑郁量表(HAMD-17)评分显著下降,其中56例患者(50.91%)达到缓解(HAMD-17≤7),其余54例仍然处于未缓解状态。
MDD患者的总体血浆代谢组特征与健康对照有显著差异,与健康对照相比,MDD患者的7种代谢物富集,37种代谢物缺失,特征为有机酸代谢物水平较高,其中大部分为脂肪酸。
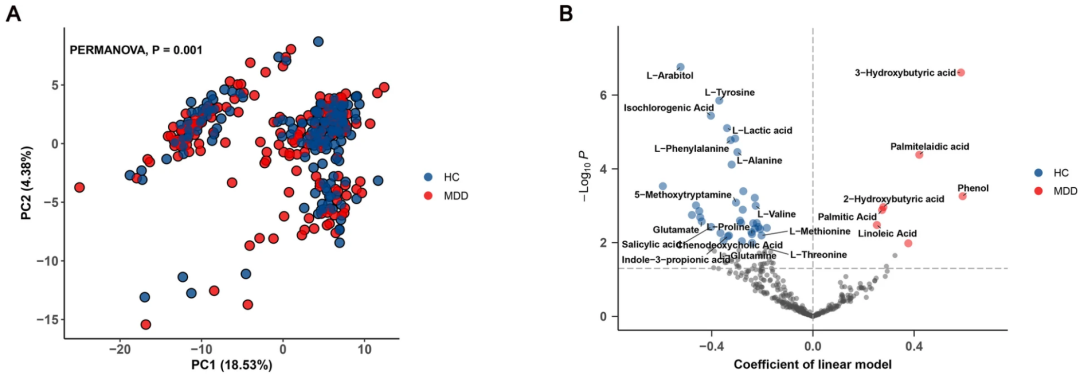
健康对照(蓝)和MDD患者(红)的血浆代谢组特征
总体的代谢特征显著改变发生在第12周,血浆代谢组的变化与抑郁症状改善有关。
多种氨基酸代谢物水平增加,包括L-酪氨酸、L-甲硫氨酸、L-苯丙氨酸、L-丙氨酸和L-色氨酸,并且,色氨酸代谢物3-吲哚丙酸(I3PA)显著增加,此前的研究发现,I3PA可能与神经再生和修复有关。相比之下,有机酸的水平显著下降,包括硬脂酸、油酸、亚油酸、2-羟基丁酸和软脂酸等。
增加的代谢物在健康对照的代谢组中富集,而下降的则在MDD患者的代谢组中富集。这意味着,ESC通过增加氨基酸代谢和减少脂肪酸代谢来改善MDD患者血浆代谢的失调。
还有一个有意思的现象是,“好”代谢物,即健康对照中富集的代谢物,如L-酪氨酸、L-色氨酸和I3PA的增加,以及“坏”代谢物,即MDD患者中富集的代谢物的减少,仅发生在缓解亚组中。这表明,缓解与非缓解的MDD患者血浆代谢物的变化存在差异,并且与ESC的治疗结果有关。
ESC治疗使得参与者的肠道微生物在物种水平上多样性降低,但基因水平上没有,亚组分析显示,非缓解组在12周内,物种水平上,肠道微生物多样性下降显著,基因水平上,在前2周内则呈增加趋势,而缓解组无论是物种水平还是基因水平均没有显著变化。缓解组的微生物多样性在基线和12周时均高于非缓解组,但始终低于健康对照。
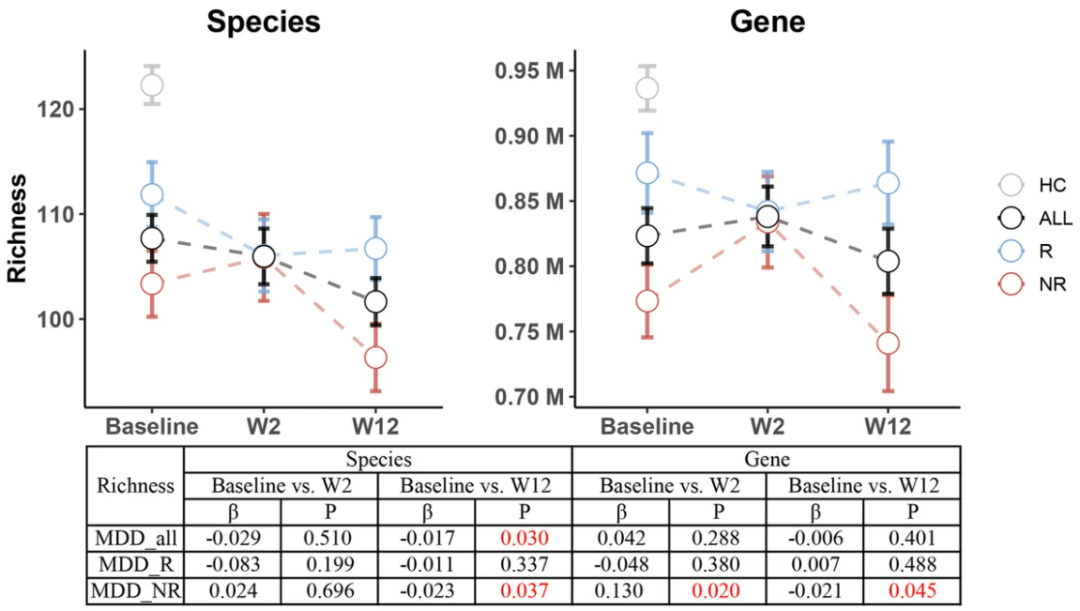
健康对照(灰)、所有MDD患者(黑)、缓解(蓝)和未缓解组(红)的物种和基因水平的多样性变化
抑郁症状的缓解与肠道微生物变化之间存在显著关联,ESC并未改善整体肠道微生物状况,但与缓解组相比,未缓解组的微生物受到的干扰更大。
虽然ESC治疗也带来了特定肠道微生物种类的显著变化,有6个种增加,9个种减少,但没有出现类似代谢组在健康对照和MDD患者中特定富集的现象。
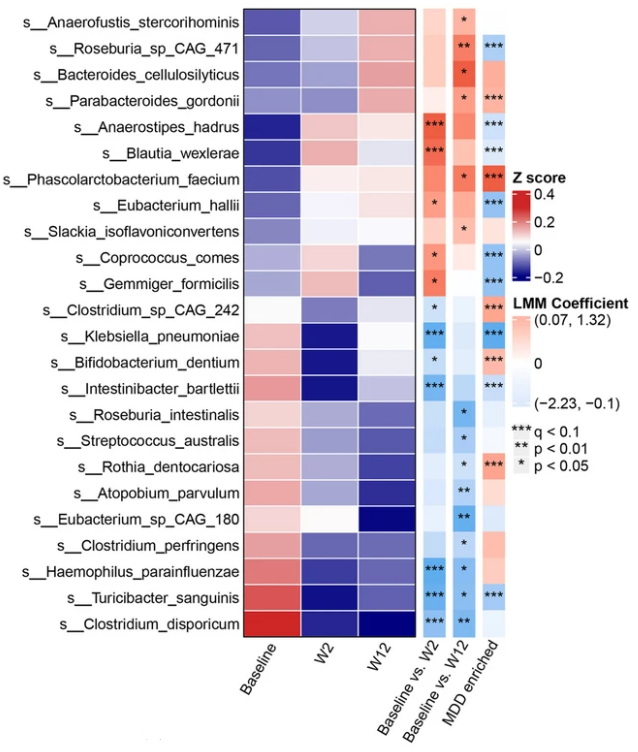
肠道微生物和代谢组的变化有可能使它们成为药物治疗效果的预测因子。以此为目标,研究人员比较了缓解和非缓解组的肠道微生物特征。
总的来看,缓解组具有更高的基线微生物多样性,更低的微生态失调评分,以及微生物组内更复杂、更有序的群体结构和细菌网络,也就是说,ESC治疗后达到缓解的MDD患者的肠道微生物组更具有弹性,对干扰的抵抗能力更强。
产孢子细菌能够抵抗外界刺激,促进肠道菌群重建,恢复肠道稳态,这些细菌在缓解组中的丰度显著更高,大多数孢子基因也是如此,因此,研究人员推测,孢子形成可能赋予了肠道微生物组对ESC诱导的干扰的抵抗能力。
基于这一猜测,他们利用机器学习构建了预测模型,证实了基线肠道微生物的孢子基因对ESC治疗12周时的抑郁症状缓解具有良好的预测效果(AUC = 0.710)。
总的来说,这项研究支持了改善肠道微生物有助于抗抑郁药治疗的效力,有助于优化针对肠道微生物和血液代谢组的抗抑郁治疗策略。
参考文献:
[1] Trivedi M H, Rush A J, Wisniewski S R, et al. Evaluation of outcomes with citalopram for depression using measurement-based care in STAR* D: implications for clinical practice[J]. American journal of Psychiatry, 2006, 163(1): 28-40.
[2] Sinyor M, Schaffer A, Levitt A. The sequenced treatment alternatives to relieve depression (STAR* D) trial: a review[J]. The Canadian Journal of Psychiatry, 2010, 55(3): 126-135.
[3] Lukić I, Getselter D, Ziv O, et al. Antidepressants affect gut microbiota and Ruminococcus flavefaciens is able to abolish their effects on depressive-like behavior[J]. Translational psychiatry, 2019, 9(1): 133.
[4] Doestzada M, Vila A V, Zhernakova A, et al. Pharmacomicrobiomics: a novel route towards personalized medicine?[J]. Protein & cell, 2018, 9(5): 432-445.
[5] Wang Y, Zhou J, Ye J, et al. Multi-omics reveal microbial determinants impacting the treatment outcome of antidepressants in major depressive disorder[J]. Microbiome, 2023, 11(1): 1-20.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


