STTT:中山大学肿瘤防治中心团队发现,免疫细胞给循环肿瘤细胞发了面“盾牌”!
来源:奇点糕 2024-04-10 14:34
研究者们发现CD45+CTCs的占比可能高达38.8%(肠癌),且在实体瘤中普遍存在。
近日,中山大学肿瘤防治中心符立梧、王芳团队在Signal Transduction and Targeted Therapy期刊发表的最新研究成果[1],揭示了CTCs抵御T细胞杀伤的重要机制:CTCs可以从来自免疫细胞的细胞外囊泡(EVs)中摄取CD45蛋白,并以此抑制T细胞受体(TCR)信号激活,相当于免疫细胞自己帮CTCs做了一面抵挡T细胞的“盾牌”,简直了啊。

论文首页截图
在传统的定义里,只有上皮细胞黏附分子(EpCAM)或细胞角蛋白(CK)表达阳性的细胞才属于CTCs,CD45这个“白细胞共同抗原”(在所有白细胞乃至有核血细胞表面均有表达)并不算是区分CTCs的标志物,但近年来的一些研究显示,非小细胞肺癌(NSCLC)等肿瘤中确实存在CD45表达阳性的细胞,且与患者不良预后相关[2]。
中山大学肿瘤防治中心的研究者们就此推测,癌细胞或许具有从EVs中摄取CD45的能力,并由此逃避免疫监视悄悄发生远处转移,所以CD45就成了“灯下黑”的盲点。研究者们随即分析了NSCLC及结直肠癌、肝癌等常见实体瘤患者血样中的CTCs(定义为CK阳性细胞),发现CD45+CTCs的占比可能高达38.8%(肠癌),且在实体瘤中普遍存在。
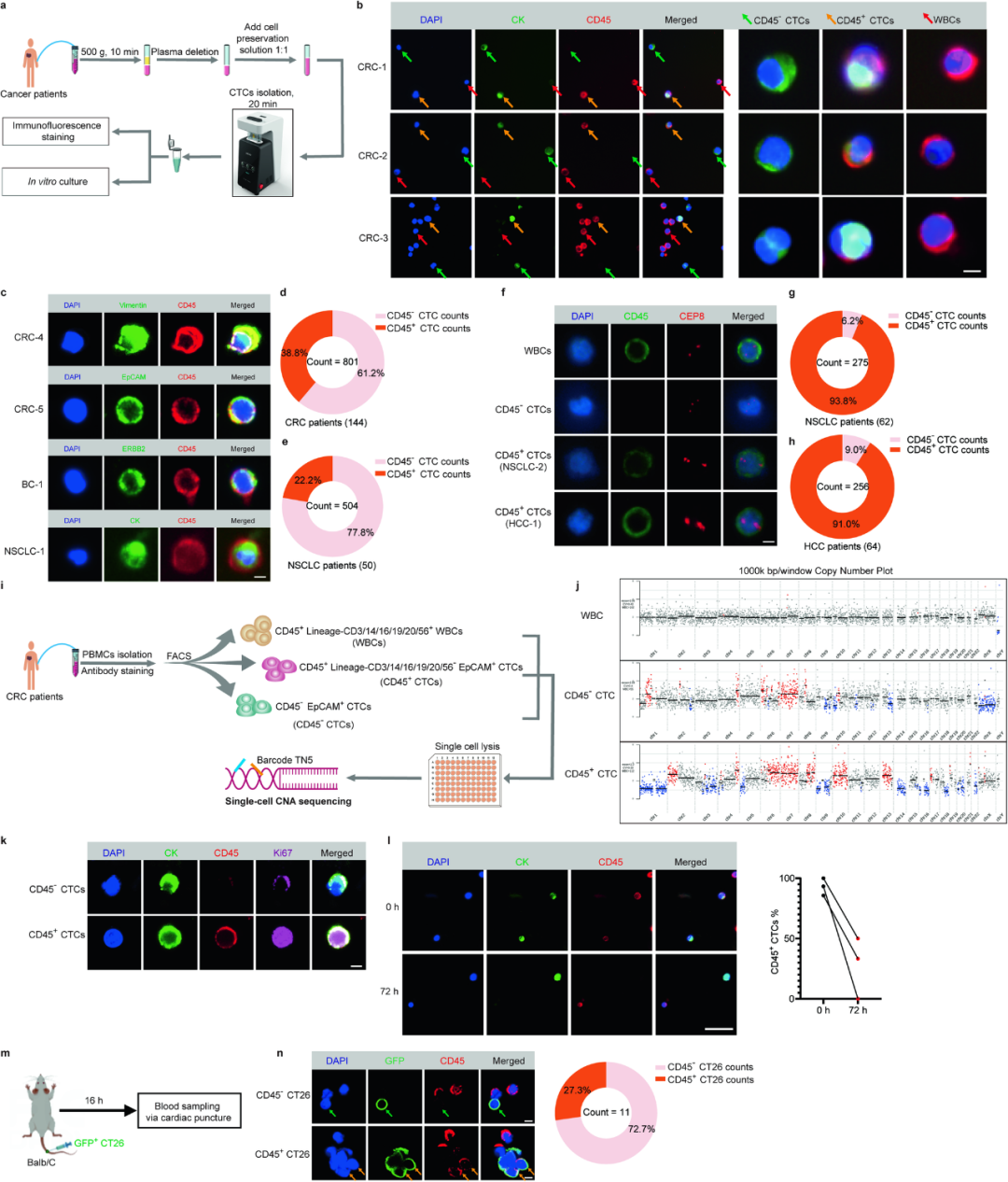
各类实体瘤中普遍存在CD45+CTCs
借助单细胞测序评估基因拷贝数变化(CNAs),研究者们证实这些CD45+CTCs确实源自肿瘤,而被分离出来单独培养时,CTCs的CD45阳性率会随时间推移不断下降,说明它们自身恐怕不能合成CD45,大概率是从外界摄取而来的,这就符合研究者们的初步推测了。
而结合患者资料来看,已发生远处转移的肠癌患者,可检出CD45+CTCs的比例明显高于未发生转移的患者(69.1% vs. 30.3%),且CD45+CTCs计数和在全部CTCs中的占比也更高,说明CD45+CTCs可能有更强的转移潜能;以CD45+CTCs高计数(定义为5毫升血样中存在≥3个),预测肠癌患者发生远处转移的准确率接近85%(AUC=0.8487)。
那么CD45+CTCs是从哪里搞来的CD45呢?细胞共培养实验显示,肠癌细胞与白细胞或血液系统癌细胞(Jurkat细胞/THP-1细胞)共培养16小时后,细胞表面就显著富集表达了CD45,而从血液系统癌细胞培养基中收集的EVs也确实含有CD45;免疫荧光染色和流式细胞术分析证实,CTCs可以通过内化(internalization)将EVs内的CD45“吞进来”。
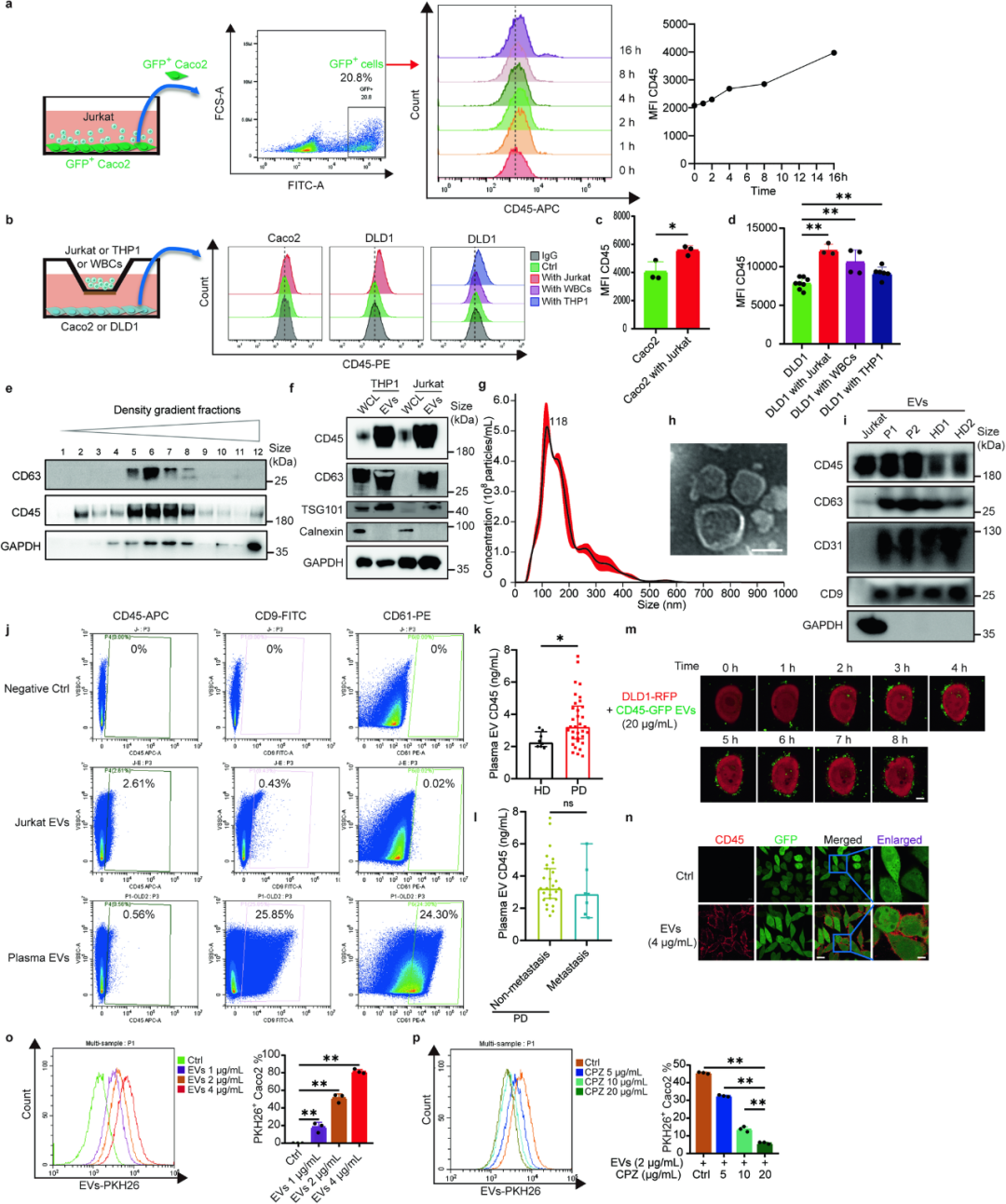
CTCs可内化来自EVs的CD45
获取到CD45的CD45+CTCs,随即在共培养实验中表现出了对T细胞杀伤的显著抵抗力,且CD8+T细胞产生IFN-γ、TNF-α等关键细胞因子的能力也下降,意味着它们的激活状态下滑,但NK细胞介导的杀伤并不受明显影响,说明CD45+CTCs的免疫逃逸主要与T细胞有关,且CD45的存在可能使癌细胞具有了免疫抑制特征;研究者们又在小鼠实验中证实,表达CD45的肠癌细胞较不表达的细胞,更容易在小鼠肺部形成远处转移灶,而且无论表达CD45的肠癌细胞计数高低,远处转移都更容易也更早。
好了,最后一个问题来了:CD45+CTCs凭什么能抵御T细胞的杀伤呢?原因当然出在CD45这个T细胞的“信号守门员”[3]身上:分析显示,如果CTCs表面存在CD45,那么它就会与T细胞表面的CD45发生同源相互作用(即CD45的二聚化),随即使TCR复合物与pMHC复合物的结合受影响,T细胞就无法与抗原呈递细胞间形成免疫突触,正常的免疫监视和杀伤功能随即减弱,CTCs就能够逃掉了,但CD45介导这一过程的机制还有待进一步阐明。
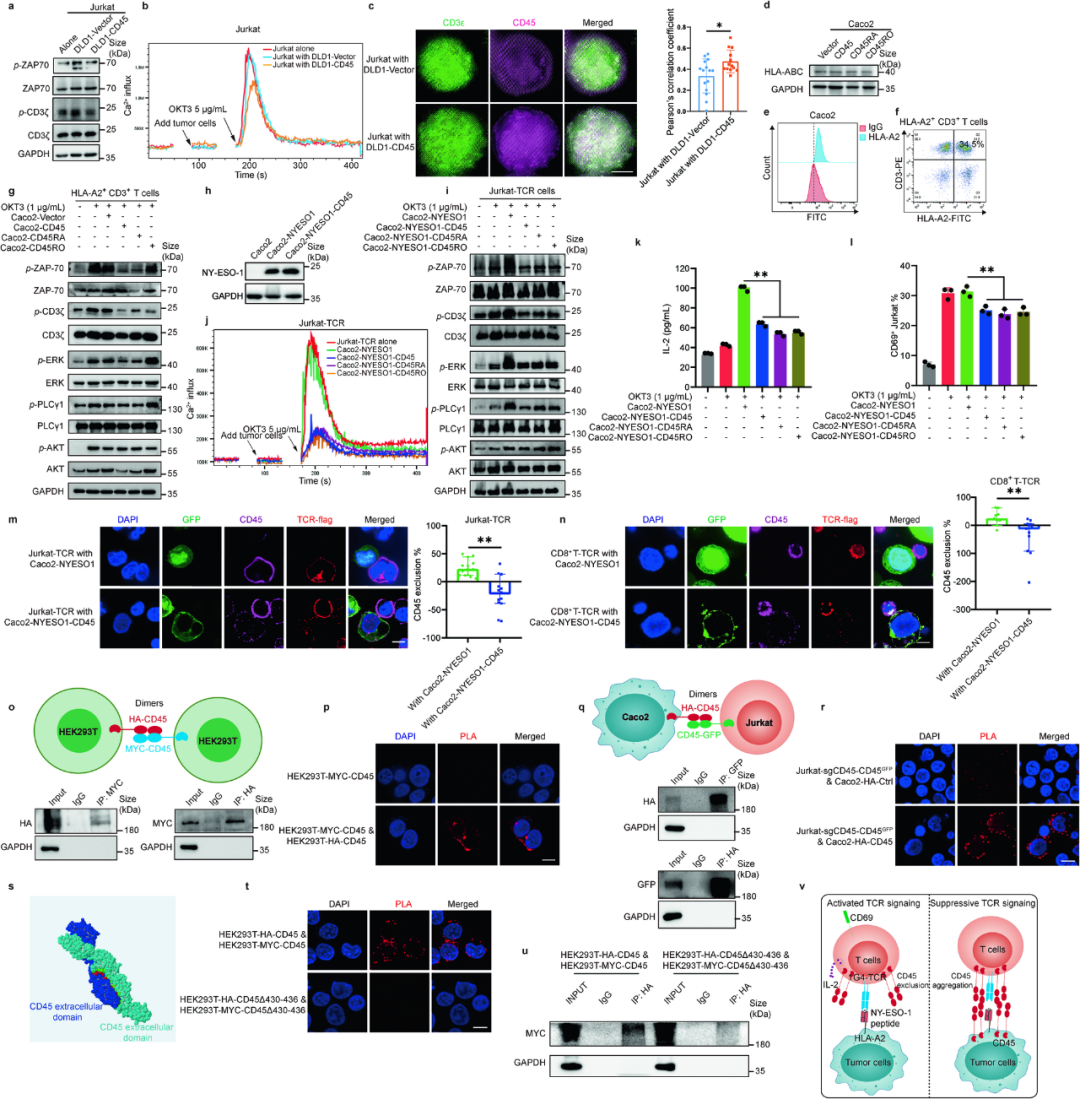
CTCs表面CD45抑制TCR信号的可能机制
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


