西湖大学最新Nature论文:马丹/吴旭冬团队解析人类线粒体丙酮酸转运蛋白的结构和机制
来源:生物世界 2025-03-21 10:01
在这项研究中,研究团队报告了人源线粒体丙酮酸转运蛋白(MPC)在三种不同状态下的六种冷冻电镜结构。
西湖大学生命科学学院马丹课题组与吴旭冬课题组、卢培龙课题组合作(梁嘉明、史珺辉、宋爱龙为共同第一作者),在 Nature 期刊发表了题为:Structures and mechanism of human mitochondrial pyruvate carrier 的研究论文。
该研究首次揭示了人体细胞线粒体内膜上的线粒体丙酮酸转运蛋白(MPC)运输丙酮酸的全过程,并找到抑制 MPC 活性的通用方式,对以 MPC 为对象开发特定代谢依赖性癌症、糖尿病等代谢紊乱相关疾病的靶向药物具有重大指导意义。

在这项研究中,研究团队报告了人源线粒体丙酮酸转运蛋白(MPC)在三种不同状态下的六种冷冻电镜结构:在内膜空间(IMS)开放状态下于不同条件下获得的三个结构,其最高分辨率为 3.2 Å;一个经丙酮酸处理处于封闭状态的 MPC 结构,分辨率为 3.7 Å;以及两个分别与抑制剂 UK5099 或抑制性纳米抗体结合处于基质侧状态的结构,其分辨率分别为 3.2 Å 和 3.0 Å。
MPC 被分配到由 MPC1 和 MPC2 组成的异二聚体中,其跨膜结构域呈现伪 C2 对称性。在 IMS 开放状态和封闭状态之间发生近似刚体运动,而主要在基质侧的结构变化则促进了封闭状态与面向基质状态之间的转换,揭示了丙酮酸转运过程中的交替进入机制。在 UK5099 结构中,抑制剂契合良好,并与朝向基质侧敞开的一个口袋广泛相互作用。
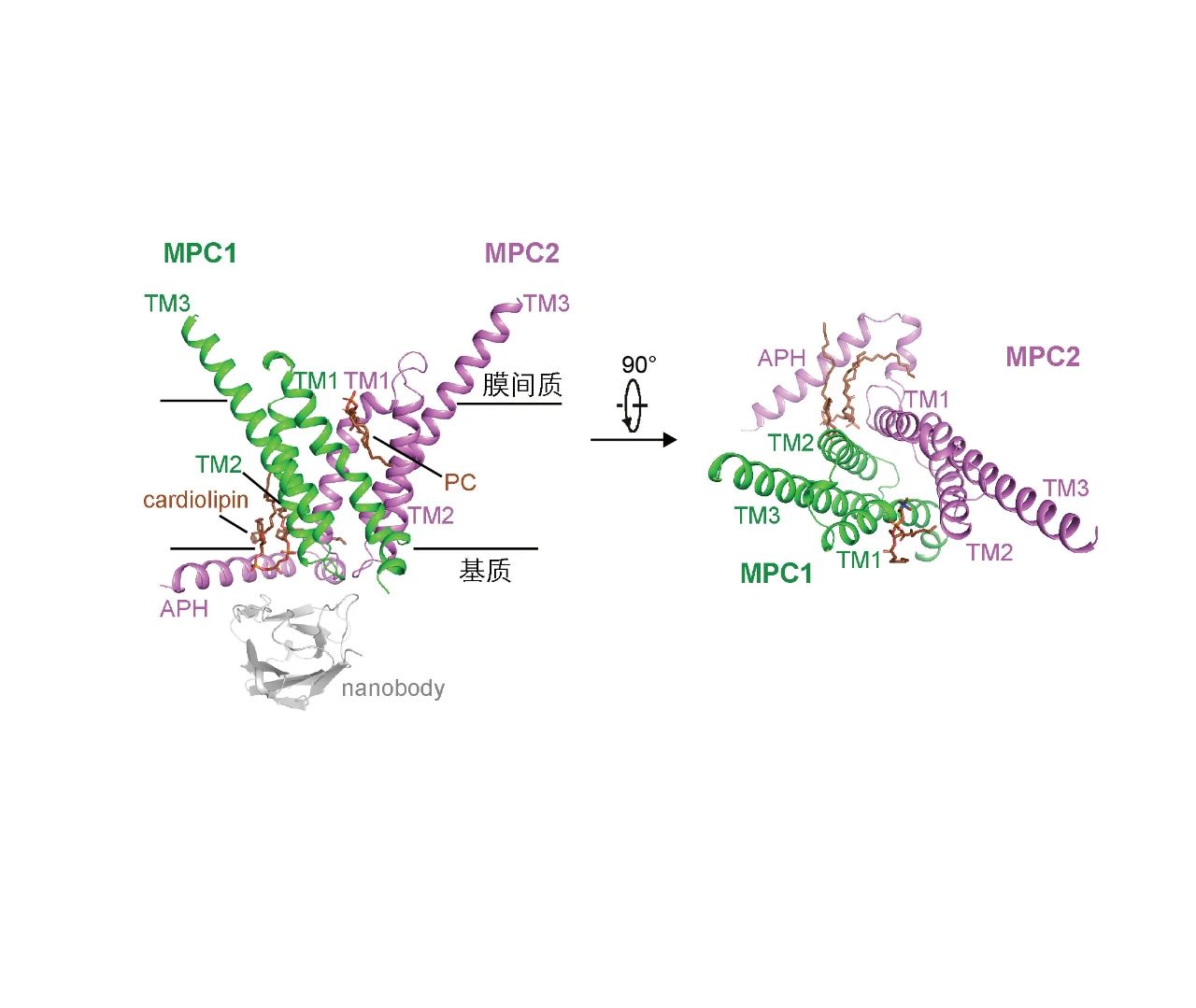
MPC的整体结构
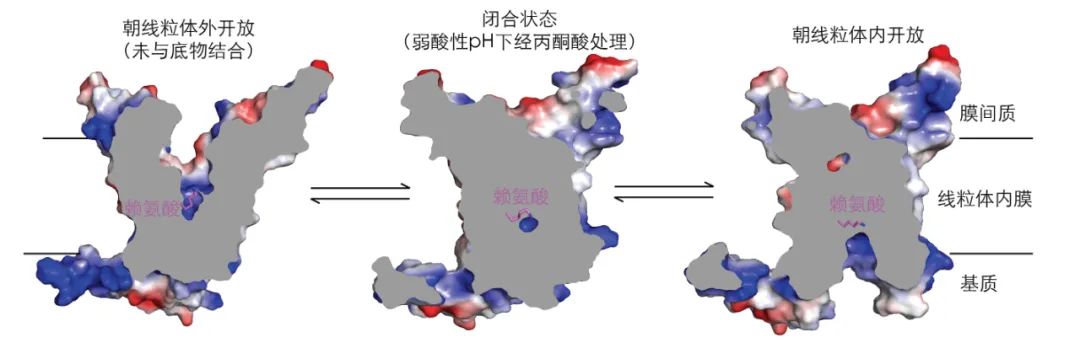
丙酮酸转运过程中MPC的整体构象变化
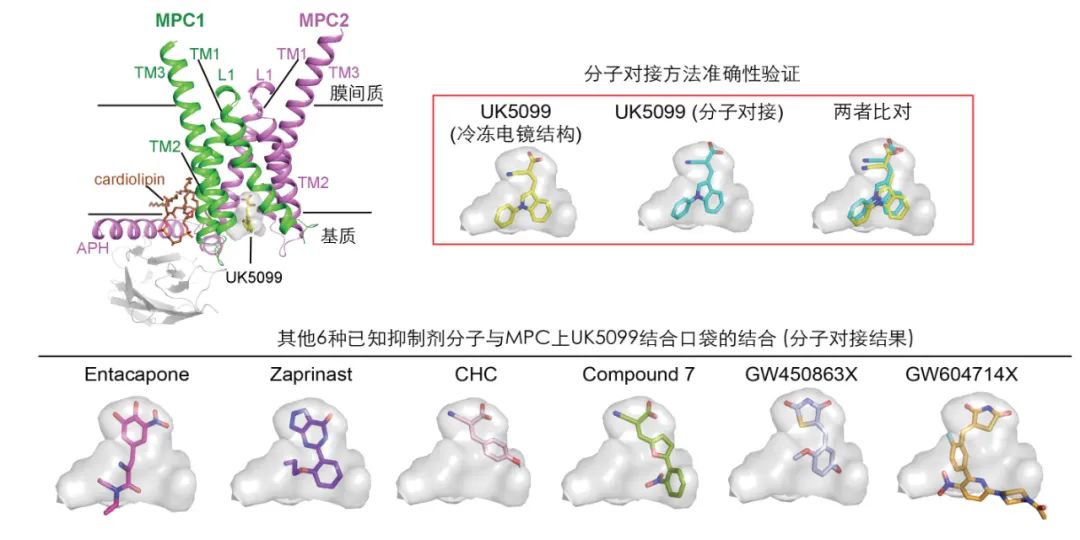
MPC与不同抑制剂分子的结合(灰色透明部分代表UK5099结合口袋)
这些研究结果为 MPC 介导的底物转运机制以及抑制剂 UK5099 的识别和抑制作用提供了重要见解,这将有助于未来针对 MPC 的药物开发。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


