两登NEJM,连战连捷!首个靶向IDH1突变的精准治疗药物研究数据再登ASCO,显示全方位治疗获益,它到底有多牛?
来源:奇点糕 2022-06-17 10:13
更加高效、精准、安全的治疗新药,是抗癌路上每个参与者都希望看到的。相信未来随着分子诊断不断普及、临床研究逐步推进,艾伏尼布还会惠及更多IDH1突变的癌症患者,让治疗获益更加全面和深远。
发展到今天的癌症治疗,已经深深打上了科学、规范和精准的烙印,所以每一种能够上市的新药,都是跨过山和大海,闯过临床研究严苛考验的佼佼者。
而“首创新药”(First-in-class)面临的挑战和难关就更多了,不管是治疗某个瘤种,还是靶向一个特定位点,这类新药都宛如在黑暗中独自摸索,没有人能在研究开始前轻言成功。
但为了让患者有药可用,这样的探索就一定要有。靶向IDH1突变急性髓系白血病(AML)的首个精准治疗药物——艾伏尼布,就在临床研究中连战连捷,使用范围从后线治疗逐步扩大到一线,堪称是当前白血病靶向治疗的典范。
艾伏尼布称得上是血液肿瘤靶向治疗的代表
“出道即登顶”
与很多抗肿瘤新药类似,艾伏尼布最先开展临床探索的IDH1突变AML患者人群,是既往预后非常不理想的复发/难治性(R/R AML)患者,临床I期研究AG120-C-001的相关结果,最早在2018年美国临床肿瘤学会(ASCO)年会上公布。
在亮相ASCO年会的同时,研究的论文还同步在《新英格兰医学杂志》上正式刊发[1]。能有这么高规格的临床I期研究,哪怕是在癌症精准治疗的大时代也不多见,也足以说明艾伏尼布对AML精准治疗的重要意义。
从设计上来说,AG120-C-001是典型的临床早期、剂量递增+后续扩展队列研究,其中179例R/R AML患者接受每日一次500毫克艾伏尼布治疗,是疗效分析的主要对象。研究首先评估艾伏尼布治疗的安全和耐受性,然后分析其抗肿瘤作用。

AG120-C-001研究的整体概况
安全性方面的数据显示,艾伏尼布治疗相关≥3级不良事件的发生率仅为20.7%,且IDH分化综合征、心电图QT间期延长、白细胞增多等需要特别关注的不良事件发生率并不高,大多都可通过剂量调整和对症治疗解决,极少出现永久性停药。
评价疗效时,研究主要关注的指标是完全缓解(CR)及CR伴血细胞计数部分恢复(CRh),而艾伏尼布治疗的CR+CRh率为31.8%,CR+CRh患者的中位缓解持续时间(DoR)为8.2个月,显示它能够诱导较为持久的疾病缓解。
在生存数据方面,艾伏尼布治疗患者的中位总生存期(OS)为9.0个月,其中CR+CRh患者中位OS可达18.8个月。后续一项匹配历史对照数据的分析显示,艾伏尼布能使IDH1突变R/R AML患者整体死亡风险下降60%(OS HR=0.396),1年生存率提高近3倍(29.1% vs. 10.8%),带来显著的生存获益[2]。
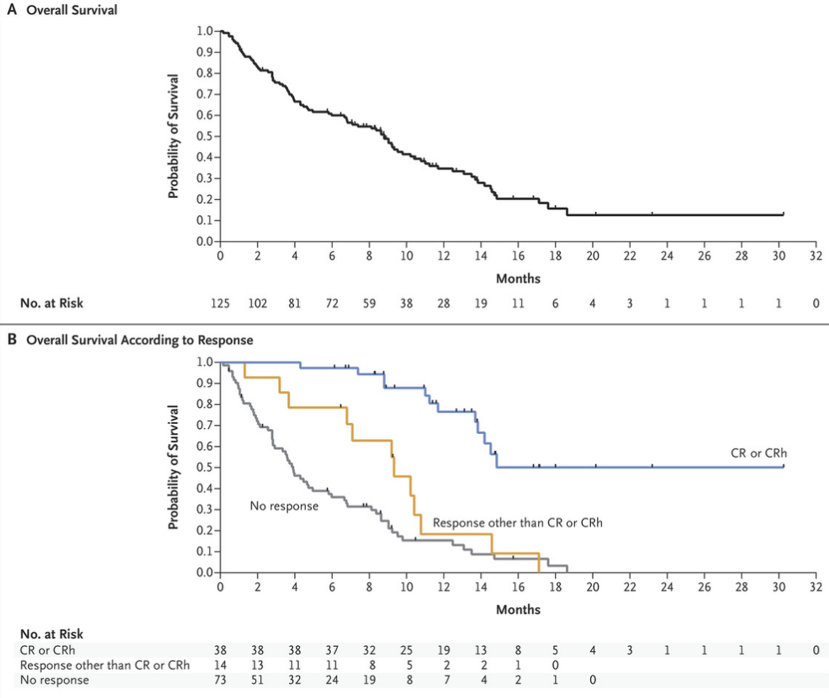
艾伏尼布治疗患者的生存情况分析
(图片来源:NEJM)
有如此之好的疗效和安全性,治疗的又是迫切需要新疗法的R/R AML患者,艾伏尼布凭借AG120-C-001研究结果被FDA快速批准上市,也就完全顺理成章了。
而为了评估艾伏尼布治疗我国患者的药代动力学/药效动力学(PK/PD)特征及疗效和安全性,我国学者又开展了CS3010-101桥接研究,这项研究也成为艾伏尼布近期在我国获批R/R AML治疗适应证的主要依据。
CS3010-101研究结果在2021年欧洲肿瘤内科学会(ESMO)年会上以优选口头报告形式(proffered paper presentation)公布,该研究共纳入30例携带IDH1突变(IDH1-R132)的R/R AML患者,使用每日一次500毫克艾伏尼布治疗。
在30例可评估疗效的患者中,主要疗效终点即CR+CRh率为36.7%(11/30),且11例患者均达到CR,这部分患者的中位DoR尚未达到,预估缓解能持续12个月的患者比例则高达90.9%,全部患者的中位OS则为9.1个月,上述疗效数据以及安全性,整体均与AG120-C-001研究保持一致,提示了艾伏尼布对我国患者的治疗价值[3]。
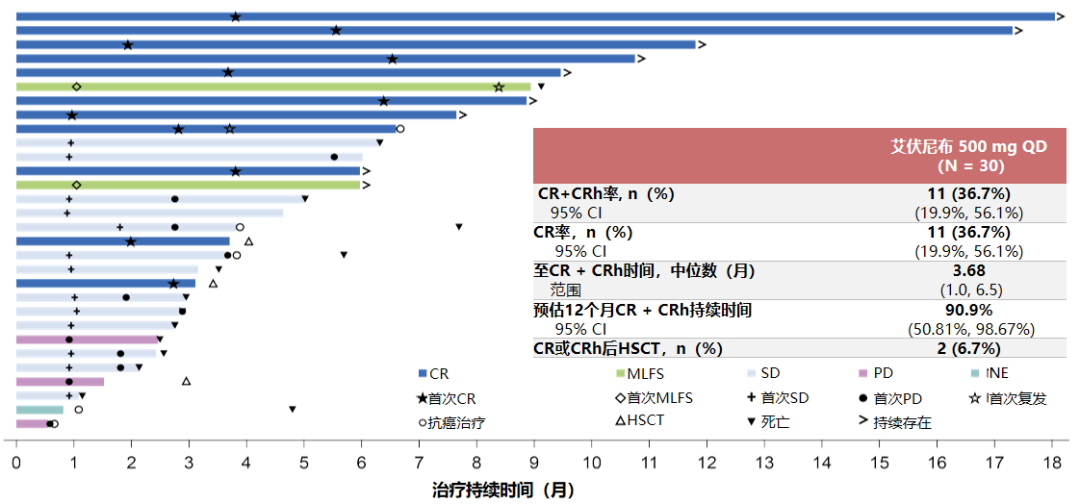
CS3010-101研究中,艾伏尼布治疗的持续时间和最佳缓解状况
后线治疗高奏凯歌,下一步就是向一线治疗进军,如果艾伏尼布更早地加入到AML患者的诱导缓解治疗当中,能否更好地控制病情进展,延长患者生存呢?
搭档出击,为更好的疗效
其实艾伏尼布用于初治AML患者的探索,早在AG120-C-001研究时就开始了:2019年ASCO年会公布的更新数据显示,对33例不适合既往标准一线治疗的患者,艾伏尼布治疗的CR+CRh率达到42.4%,患者中位OS则是12.5个月[4]。
艾伏尼布由此获得了FDA的单药一线治疗适应证批准。不过为进一步提高缓解率,让更多患者获得更长久的获益,艾伏尼布并未止步于此,随即开展了多项一线联合治疗的临床研究探索。
其中对于不可耐受强化诱导治疗的患者,艾伏尼布联合常用去甲基化药物阿扎胞苷(AZA)的方案,在临床前研究中表现出了协同增效性,联合方案诱导癌细胞凋亡的效果,较两种药物各自单独使用时更好[5-6]。
2019年ASCO年会公布的临床Ib/II期AG221-AML-005研究,就评价了在不可耐受一线强化诱导治疗的IDH1突变阳性AML患者中,艾伏尼布+阿扎胞苷治疗的安全性和初步疗效。结果显示,艾伏尼布+阿扎胞苷联合治疗的CR+CRh率提高到了69.6%,后续中位随访16.1个月时,患者的中位DoR和OS都尚未达到,预估的12个月生存率也达到82%[7],在疗效出色的同时,也显示了良好的安全性。
因此,艾伏尼布+阿扎胞苷方案也很快推进到了临床III期研究阶段,其一线治疗不可耐受强化诱导治疗AML患者的AGILE研究提前报告了阳性结果,研究全文不久前也登上了《新英格兰医学杂志》[8]。
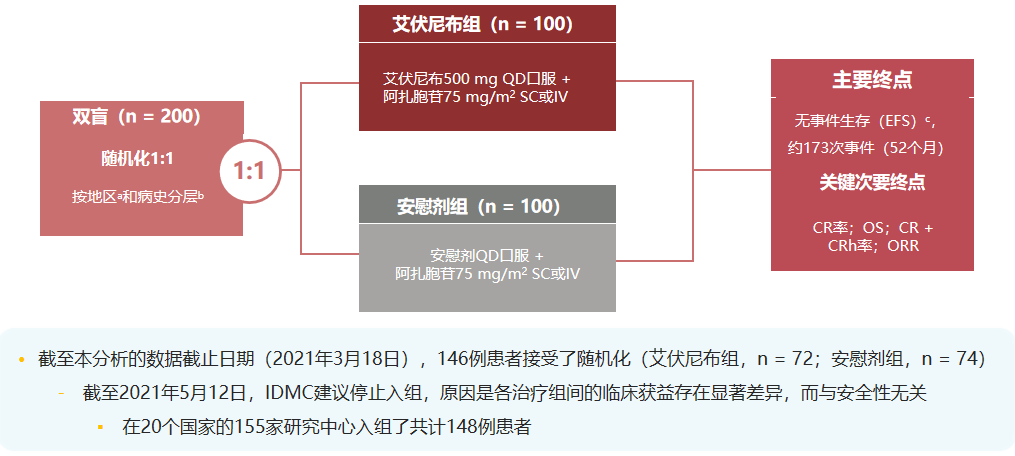
AGILE研究设计情况
在CR率(47.2% vs. 14.9%)、CR+CRh率(52.8% vs. 17.6%)、中位DoR(22.1个月 vs. 9.2个月)、中位OS(24.0个月 vs. 7.9个月)等多个疗效终点方面,艾伏尼布+阿扎胞苷方案相比对照组阿扎胞苷单药治疗,都体现了明确的优势。

AGILE研究整体疗效数据
也正因为艾伏尼布+阿扎胞苷方案优势明确,在独立数据监察委员会的建议下,AGILE研究的入组已经提前终止。此外在安全性方面,联合治疗并未显著增加≥3级不良事件的整体发生率,患者自评的生活质量也呈现相对更好的趋势。
近期在2022年ASCO年会、欧洲血液学协会(EHA)年会等国际学术会议上公布的AGILE研究最新分析数据,也提示了艾伏尼布+阿扎胞苷方案的全方位治疗获益,例如从血液学角度评价,联合治疗能够显著提高患者的血细胞计数恢复率,并让更多患者脱离对输注血小板、红细胞的依赖[9]。
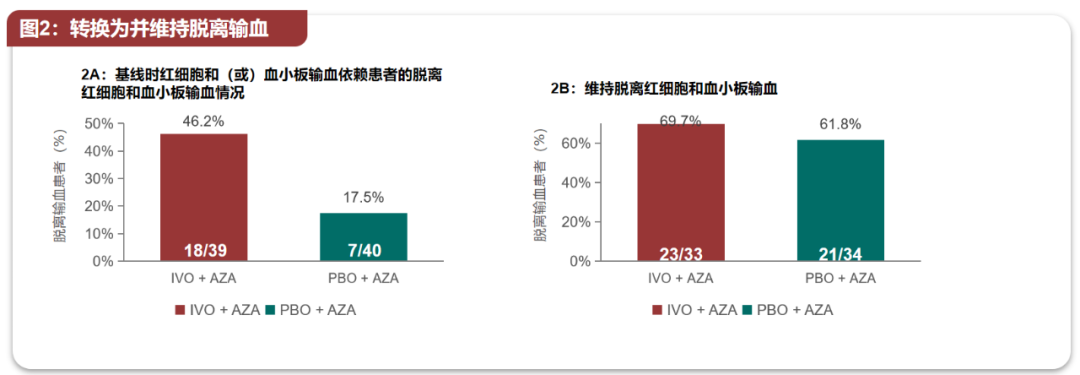
艾伏尼布治疗能使更多患者摆脱输血依赖
分子层面的分析则显示,IDH1突变持久清除是提示临床获益的重要指标,艾伏尼布+阿扎胞苷组达到CR+CRh,且纳入分析的35例患者中,有21例(60%)实现突变清除,比例显著高于安慰剂组的36.4%,患者的共突变则无明显影响[10]。
总而言之,基于AGILE研究的优异数据,2022年5月25日,美国FDA正式批准艾伏尼布联合阿扎胞苷,用于治疗75岁及以上或因其它合并症,无法接受强化诱导治疗的IDH1突变阳性初诊AML患者。
而艾伏尼布的临床探索,还在同时拓宽深度和广度,例如本届ASCO年会上报告了AG120-C-001研究中,艾伏尼布用于携带IDH1突变的复发/难治性骨髓增生异常综合症(MDS)患者的疗效:数据显示,艾伏尼布治疗的客观缓解率达到80%,且超过一半的R/R MDS患者实现完全缓解,中位OS也接近3年(35.7个月)[11]。
另一项亮相ASCO年会的最新临床研究则显示,艾伏尼布联合BCL-2抑制剂维奈克拉和阿扎胞苷组成三联方案,用于新发/继发AML、R/R AML和MDS/骨髓增殖性肿瘤(MPN)等多种血液系统恶性肿瘤的治疗时,初步报告的客观缓解率都有75-100%,且患者能够实现持久缓解和长期生存[12]!

三联方案按不同剂量水平,用于不同患者的疗效
更加高效、精准、安全的治疗新药,是抗癌路上每个参与者都希望看到的。相信未来随着分子诊断不断普及、临床研究逐步推进,艾伏尼布还会惠及更多IDH1突变的癌症患者,让治疗获益更加全面和深远。
参考文献:
1.DiNardo C D, Stein E M, de Botton S, et al. Durable remissions with ivosidenib in IDH1-mutated relapsed or refractory AML[J]. New England Journal of Medicine, 2018, 378(25): 2386-2398.
2.Paschka P, Dombret H, Thomas X, et al. Ivosidenib improves overall survival relative to standard therapies in relapsed or refractory mutant IDH1 AML: results from matched comparisons to historical controls[J]. Blood, 2020, 136(S1): 18-19.
3.Wang J, Jin J, Yin Q, et al. 825O Ivosidenib in Chinese patients (pts) with relapsed/refractory acute myeloid leukemia (R/R AML) with an IDH1 mutation: Results from a bridging registrational study[J]. Annals of Oncology, 2021, 32(S5): S773.
4.Roboz G J, Dinardo C D, Stein E M, et al. Ivosidenib (IVO; AG-120) in IDH1-mutant newly-diagnosed acute myeloid leukemia (ND AML): Updated results from a phase 1 study[J]. Journal of Clinical Oncology, 2019, 37(15_suppl): 7028.
5.Yen K, Chopra V S, Tobin E, et al. Abstract 4956: Functional characterization of the ivosidenib (AG-120) and azacitidine combination in a mutant IDH1 AML cell model[J]. Cancer Research, 2018, 78(13_Supplement): 4956.
6.Hudson C, Narayanaswamy R, Ronseaux S, et al. Abstract 1339: Investigations into rational combination approaches with ivosidenib in a mutant IDH1 acute myeloid leukemia patient-derived xenograft model[J]. Cancer Research, 2021, 81(13_Supplement): 1339.
7.DiNardo C D, Stein A S, Stein E M, et al. Mutant isocitrate dehydrogenase 1 inhibitor ivosidenib in combination with azacitidine for newly diagnosed acute myeloid leukemia[J]. Journal of Clinical Oncology, 2020, 39(1): 57-65.
8.Montesinos P, Recher C, Vives S, et al. Ivosidenib and Azacitidine in IDH1-Mutated Acute Myeloid Leukemia[J]. New England Journal of Medicine, 2022, 386(16): 1519-1531.
9.Dohner H, Montesinos P, Polo S V, et al. Hematologic improvements with ivosidenib+ azacitidine compared to placebo+ azacitidine in patients with newly diagnosed acute myeloid leukemia[J]. Journal of Clinical Oncology, 2022, 40(suppl 16): 7042.
10.De Botton S, Choe S, Marchione D M, et al. Molecular characterization of clinical response in patients with newly diagnosed acute myeloid leukemia treated with ivosidenib+ azacitidine compared to placebo+ azacitidine[J]. Journal of Clinical Oncology, 2022, 40(suppl 16): 7019.
11.Sallman D A, Foran J M, Watts J M, et al. Ivosidenib in patients with IDH1-mutant relapsed/refractory myelodysplastic syndrome (R/R MDS): Updated enrollment and results of a phase 1 dose-escalation and expansion substudy[J]. Journal of Clinical Oncology, 2022, 40(suppl 16): 7053.
12.Lachowiez C A, Garcia J S, Borthakur G, et al. A phase Ib/II study of ivosidenib with venetoclax+/-azacitidine in IDH1-mutated hematologic malignancies[J]. Journal of Clinical Oncology, 2022, 40(suppl 16): 7018.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


