Nature:揭示“黑暗”基因组促使宿主机体检测到癌细胞背后的分子机制
来源:生物谷原创 2023-04-28 14:28
来自哥伦比亚大学等机构的科学家们通过研究揭示了基因组中的“黑暗”部分是如何促使癌细胞被宿主机体的免疫系统所检测到的,这一研究或有望帮助开发出更好的免疫疗法。
蛋白质的翻译普遍存在于经典的基因编码区域之外,发生在长链非编码RNAs、经典的非翻译区和内含子中,尤其是在衰老、神经退行性疾病和癌症中;值得注意的是,大多数的肿瘤特异性抗原都是非编码翻译的结果。尽管所产生的多肽(polypeptides)往往是无功能的,但非编码区域的翻译对于新的编码序列的诞生则是非常必要的,对多种非编码区域翻译的监督机制以及逃逸多肽如何进化出新的功能,目前研究人员并不清楚,从有注释的非编码序列中所衍生的功能性多肽通常会被定位到膜上。近日,一篇发表在国际杂志Nature上题为“Noncoding translation mitigation”的研究报告中,来自哥伦比亚大学等机构的科学家们通过研究揭示了基因组中的“黑暗”部分是如何促使癌细胞被宿主机体的免疫系统所检测到的,这一研究或有望帮助开发出更好的免疫疗法。
机体的免疫系统能通过细胞的肿瘤特异性抗原来识别癌细胞,这些抗原是癌细胞表面所发现的特殊降解蛋白的片段,此前研究结果表明,绝大多数的肿瘤特异性抗原都是由非编码的基因组所编码产生的,而这些非编码的基因组就是科学家们直到现在还坚信的不能编码任何蛋白的基因组的“黑暗”部分。那么肿瘤又是如何展示这些“黑暗”蛋白的片段的呢?这篇文章中,研究人员给出了明确的答案。
研究者Xuebing Wu说道,此前很多研究都尝试描述这一过程,但每项研究都只关注到一个或少数几个DNA序列,这些研究取得了重要的发现,但其彼此之间似乎又没有什么共同点,目前研究人员并不清楚是否他们所发现的机制能广泛适用于基因组中所有类型的非编码序列。为了寻找一个更全面的答案,这项研究中,研究人员对大约1万个人类非编码基因序列和数百万个合成的随机序列进行大规模的平行分析,他们所发现的就是一个适用于所有类型的非编码序列的统一机制。
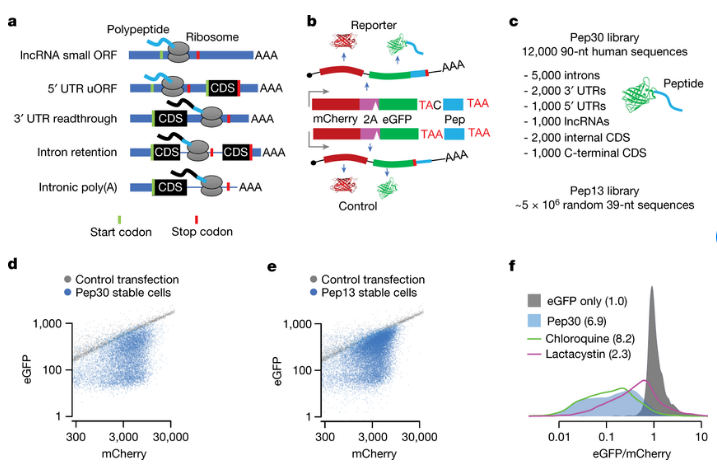
揭示“黑暗”基因组促使宿主机体检测到癌细胞背后的分子机制。
图片来源:Nature (2023). DOI:10.1038/s41586-023-05946-4
这或许就促使研究人员发现了一个非编码序列特有的信号,该信号能诱发这些非功能蛋白的降解,这也是制造抗原的第一步,随后研究人员利用CRISPR技术敲除了每一个人类基因,这或许就能揭示识别信号—BAG6复合体的特殊分子机制。因此,BAG6复合体代表了一个潜在的药物靶点,从而用于调整癌细胞对免疫系统的可见度。研究人员还补充道,肿瘤特异性抗原是我们的研究为何如此重要的原因之一,这项研究还发现了一些更基本的信息,即细胞处理非功能蛋白的方式,以及其中一些非功能蛋白最终是如何演变为有功能蛋白的。
大多数的“黑暗”蛋白质可能都是无功能,甚至在细胞中还具有毒性,需要被清除;但最新研究显示,BAG6复合体能识别出很大比例的这些蛋白质并对其进行运送从而毁灭。机体中物非功能蛋白质的产生会随着年龄的增长而增加,并可能会导致神经退行性疾病,甚至癌症等多种疾病的发生,靶向作用BAG6功能的药物或许能潜在治疗这些疾病,一旦研究人员阐明了细胞内的这种分子机制,或许就能打开开启新型疗法的大门。
综上,本文研究揭示了一种监督来自多样化非编码基因组区域进行不需要翻译的故障-安全机制,并提出了一种可能性的生化途径,从而促使新进化的蛋白质实现优先的膜定位过程。(生物谷Bioon.com)
原始出处:
Kesner, J.S., Chen, Z., Shi, P. et al. Noncoding translation mitigation. Nature (2023). doi:10.1038/s41586-023-05946-4
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


