JITC:复旦团队发现逆转肝癌免疫抑制性微环境的新突破口!
来源:奇点糕 2024-02-11 11:37
基于既往研究的HCC单细胞测序数据,复旦团队在本次研究中专门针对TAMs展开生信分析,找出了34个在HCC微环境中TAMs和正常巨噬细胞中表达存在显著差异。
近日,复旦大学附属中山医院董玲、复旦大学基础医学院张思团队在Journal for ImmunoTherapy of Cancer期刊合作发表的最新研究,就揭示了肝细胞癌(HCC)微环境中,存在一类高表达血小板活化因子乙酰水解酶(PLA2G7)、免疫抑制性极强的TAMs,抑制PLA2G7可改善免疫微环境,增援HCC免疫治疗[1]。

论文首页截图
以干预TAMs来增效HCC免疫治疗,算是近年来的研究重点方向,它们在HCC微环境中的免疫抑制性“统治力”早就臭名昭著了;但PLA2G7就有点儿跨界出演了,它此前被关注的功用主要在心血管疾病、能量代谢等方面,2022年还有登上《科学》的重量级研究揭示了PLA2G7对热量限制和延寿的影响[2],相比起来PLA2G7的癌症相关研究还真不多。
基于既往研究的HCC单细胞测序数据,复旦团队在本次研究中专门针对TAMs展开生信分析,找出了34个在HCC微环境中TAMs和正常巨噬细胞中表达存在显著差异,可能参与TAMs介导HCC免疫抑制性微环境的基因,并结合患者预后数据进一步筛选和验证,将目标基因数缩小到了7个,PLA2G7就名列其中。
而且,PLA2G7仅在HCC微环境内的巨噬细胞(特征为CD68+)中高表达,在单核细胞和树突状细胞等其它髓系细胞中表达中等,在其它免疫细胞内则很少见,因此研究者们认为它更可能是调控TAMs的关键点;来自中山医院患者队列的数据也显示,高表达PLA2G7与HCC患者总生存期(OS)较短显著相关,同时高表达PLA2G7和CD68更是凶兆。
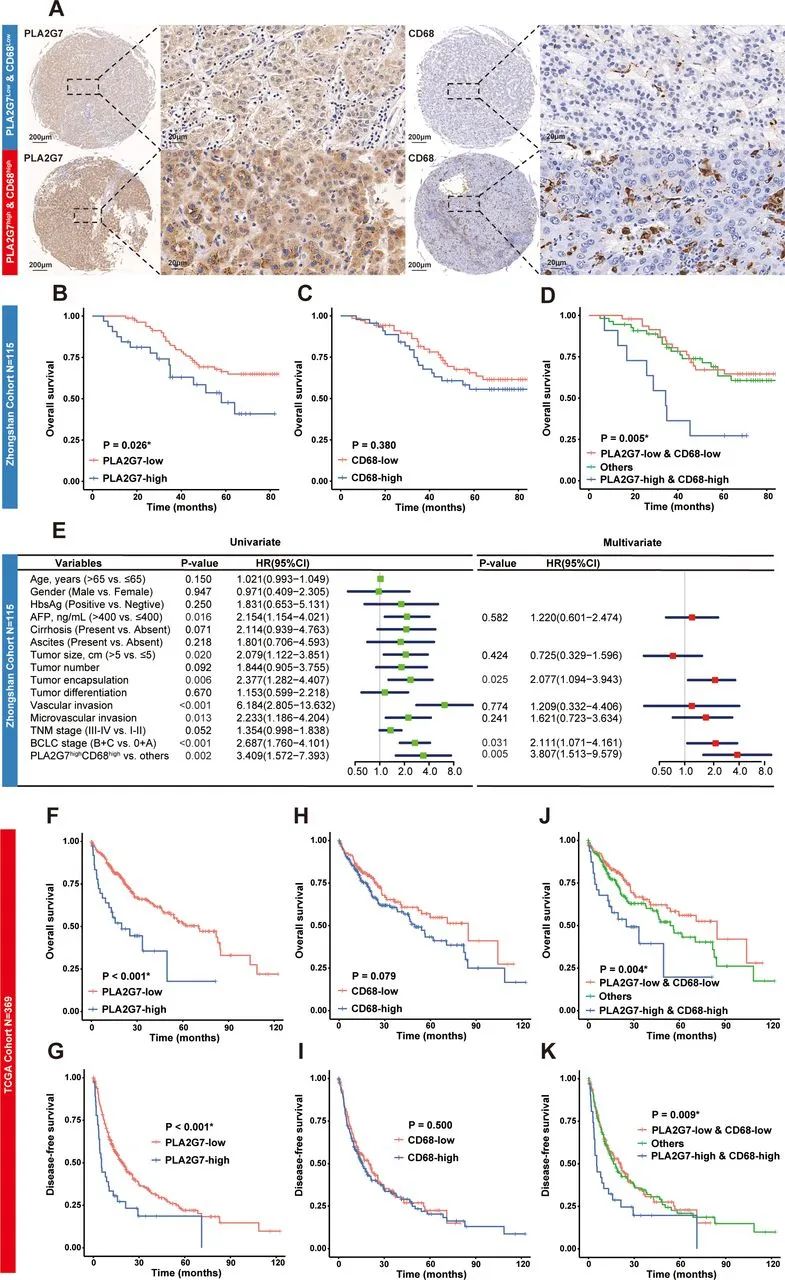
高表达PLA2G7是HCC患者生存预后的不利因素
而在接受PD-1抑制剂治疗的另一个HCC患者队列中,实现部分缓解(PR)患者的肿瘤PLA2G7和CD68表达水平,都比疾病进展(PD)患者显著更低,且PLA2G7和CD68表达水平也与CD8+T细胞浸润程度挂钩,这都提示TAMs中的PLA2G7影响了抗肿瘤免疫。
研究者们调回头来,重新分析了此前的HCC单细胞测序数据,以HCC患者肿瘤内巨噬细胞的PLA2G7表达水平进行分组,证实肿瘤内巨噬细胞高表达PLA2G7,与抗原呈递、淋巴细胞趋化性、T细胞激活减弱均显著相关,多种促炎/促T细胞激活基因的表达,也会在巨噬细胞高表达PLA2G7时显著下调,这些Debuff叠在一起显然都不利于免疫治疗。
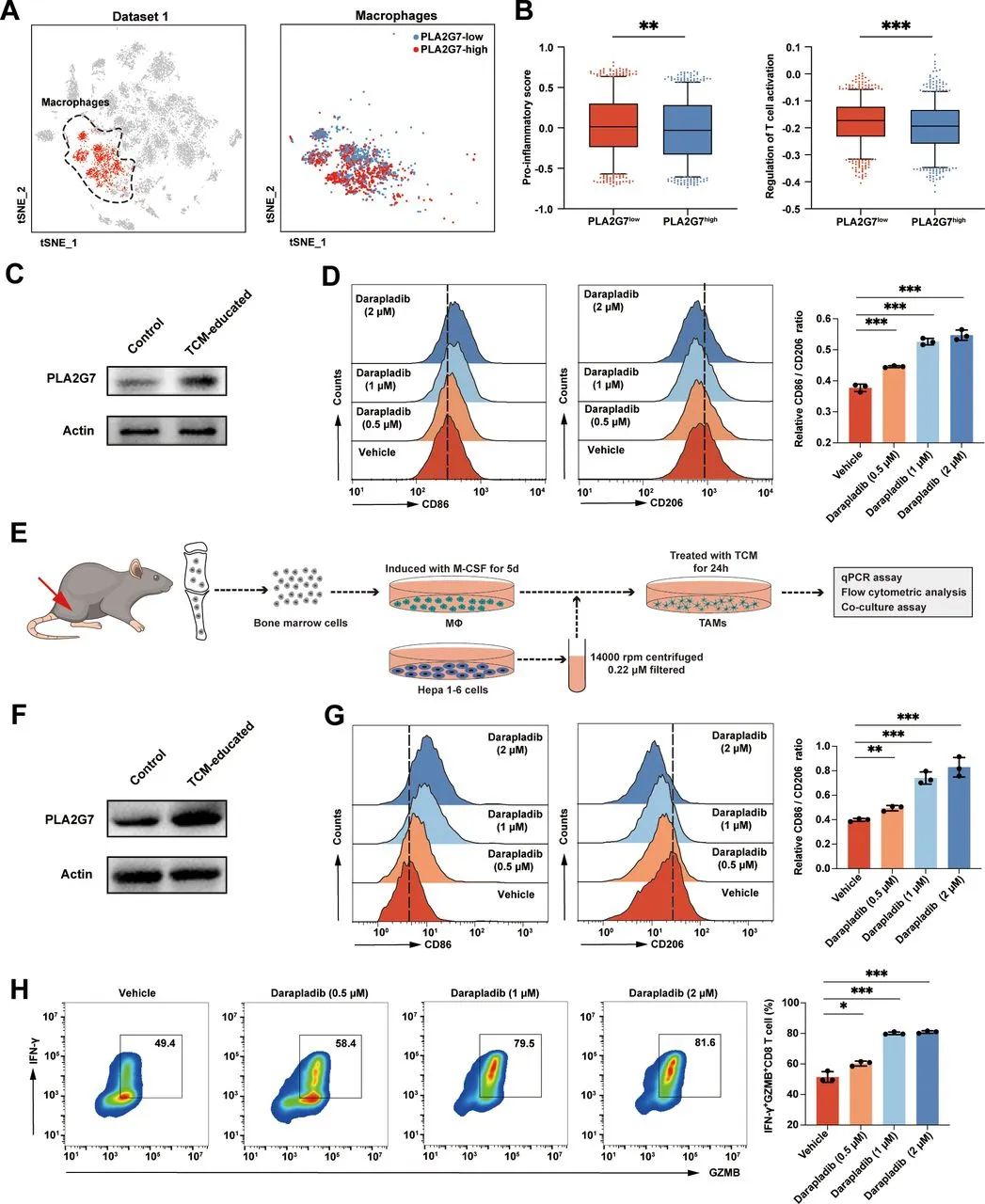
肿瘤内巨噬细胞高表达PLA2G7,往往与多种不利于抗肿瘤免疫的因素共存
沉默PLA2G7表达或使用小分子抑制剂darapladib,可一定程度上使TAMs整体向有利免疫治疗的M1型极化,与PD-1抑制剂治疗协同增效;进一步实验还显示,PLA2G7高表达会使TAMs内的NF-κB信号通路活性显著下降,这可能是PLA2G7导致TAMs呈高度免疫抑制性的关键,但更详细的分子机制还有待后续研究探索。
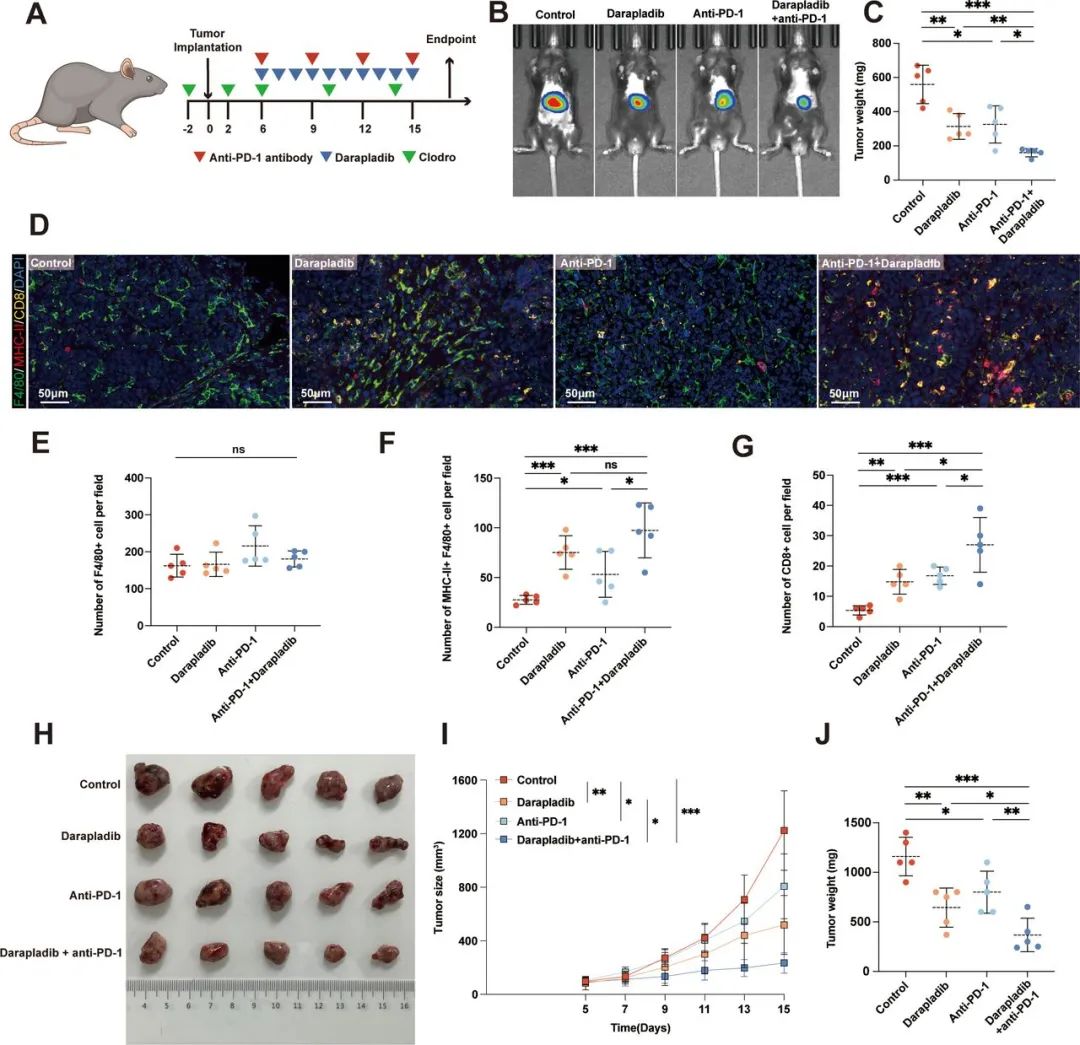
沉默PLA2G7表达或以darapladib抑制PLA2G7,可与免疫治疗实现协同增效
或许此次复旦团队的研究,能成为挽救darapladib的又一个契机,毕竟它曾在心血管疾病领域一度被寄予厚望,但又两次折戟关键临床III期研究,会不会真就“东方不亮西方亮”,它能在HCC免疫治疗时代找回自我呢?就算它不行,也要重点针对PLA2G7进行突破,冲开HCC免疫抑制性微环境的枷锁。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


