Nature:新概念新方法新发现!张泽民课题组揭示跨组织多细胞协同模式及其在肿瘤中的重塑
来源:BioArt 2025-06-01 10:44
该研究聚焦于组织层面的多细胞协同模式,创新性地提出了 “跨组织细胞模块(cellular module,CM)” 的概念,并开发了一套计算框架CoVarNet来识别细胞模块。
在过去的十多年间,单细胞组学技术的迅猛发展,为解析人体组织器官的细胞异质性提供了强大的工具。借助这一先进技术,研究人员陆续发现了诸多新的细胞类型,极大加深了我们对人体细胞类型构成的认知【1-3】。在人类细胞图谱(Human Cell Atlas, HCA)【4】等大型国际协作计划的有力推动之下,科学界成功绘制出多种组织器官的细胞图谱,并累积了海量的单细胞组学数据资源。
然而,组织器官并不是细胞类型的简单堆积,而是依赖多种细胞类型的协同配合,进而具备特定的结构与功能。以肠道黏膜上的派氏结为例,免疫细胞、基质细胞以及上皮细胞等在其中有序排列成特定的空间结构,成为黏膜免疫的关键组成部分。据此,几个重要的科学问题等待回答:这类多细胞协同模式是否在人体组织中普遍存在?如何识别这些组织层面的多细胞协同模式?以及,它们在疾病进展过程中会呈现出怎样的动态变化?
2025年5月28日,北京大学/重庆医科大学张泽民课题组在Nature期刊上发表了题为Cross-tissue multicellular coordination and its rewiring in cancer的研究论文。该研究聚焦于组织层面的多细胞协同模式,创新性地提出了 “跨组织细胞模块(cellular module,CM)” 的概念,并开发了一套计算框架CoVarNet来识别细胞模块。通过对大规模单细胞转录组公共数据的整合分析,该研究系统识别出了 12 个跨组织的细胞模块,并深入探究了这些模块的时空动态特征、内部调控关系、功能表型关联以及在肿瘤进展过程中的动态重塑情况。

首先,该研究整合了源自35种人体组织的706份健康样本的单细胞转录组公共数据,构建了一个涵盖229万个细胞的人体跨组织单细胞图谱(图1)。该图谱覆盖了7种非上皮细胞类型以及76种细胞亚型,系统地描述出人体各健康组织在细胞组成上的显著差异。例如,研究发现生殖系统中的成纤维细胞展现出较强的组织特异性。
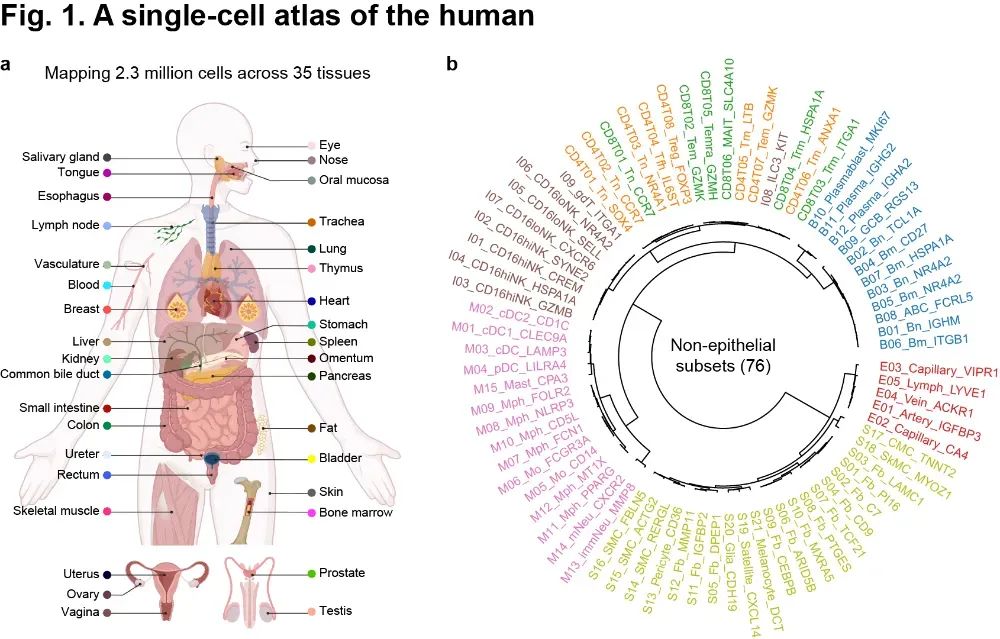
图1 人体跨组织单细胞图谱
为了系统地描绘多细胞协同模式,该研究将这一概念转化为共出现的细胞网络,并开发了一套计算框架CoVarNet来识别细胞模块网络。利用先前构建的跨组织单细胞图谱,CoVarNet鉴定出12个具有独特细胞组成和组织分布的细胞模块。具体而言,CM04、CM05、CM06 和 CM09 主要由免疫细胞构成,呈现出在免疫器官以及外周血中的富集现象;CM02 和 CM03 则在泌尿系统和胃肠道中具有较高的分布频率;CM07 和 CM12 对生殖系统表现出明显的偏好,涵盖了生殖系统相关的成纤维细胞;CM08 主要富集于与外界直接接触的屏障组织中,可能代表着黏膜相关淋巴组织;CM10 和 CM11 分别存在于血管组织以及代谢相关器官之中;而 CM01 由组织驻留巨噬细胞、通用型成纤维细胞以及淋巴内皮细胞等多种细胞类型组成,在人体大部分系统中均有广泛的分布。综上所述,这些结果充分展现了细胞模块在不同组织中的偏好性分布以及其潜在的功能作用,为后续深入探究多细胞协同模式奠定了坚实的基础。
接下来,该研究将细胞模块映射到空间转录组数据中,揭示出多细胞协同的空间景观。通过对小肠的 Visium 数据进行深入分析,研究发现 CM05 在小肠的派氏结中呈现显著富集现象,推测其可能是黏膜免疫的诱导部位。而相比之下,CM02 和 CM03 主要分布于肠黏膜,更有可能是黏膜免疫的效应场所。进一步借助高分辨率的 Xenium 数据,作者对 CM02 和 CM03 进行了更为细致的区分:CM02 在整个肠黏膜中广泛分布,包含了效应记忆 CD8 T 细胞和自然杀伤细胞等多种细胞类型;而 CM03 则主要富集在黏膜的固有层,包含 IgA+ 浆细胞和肥大细胞等。这些发现充分表明各类细胞模块在组织中承担着不同的功能角色。
此外,该研究还深入探讨了细胞模块的内部调控关系。研究结果显示,与富含基质和内皮细胞的模块相比,富含淋巴细胞的模块在空间上展现出更高的聚集性,且其产生的信号分子种类相对较为有限。这一现象表明,空间临近性可能在一定程度上增强了细胞间通讯的特异性。进一步地,基于体内扰动数据所开展的细胞因子响应分析,清晰地显示出细胞因子在细胞模块中发挥着重要的调控作用。研究发现,同一类细胞在不同的细胞模块中会表现出截然不同的细胞因子反应。例如,效应记忆 CD8+ T 细胞在 CM02、CM08 和 CM09 中对 TNF-α 表现出明显的信号响应,然而在 CM04 和 CM06 中却未见类似的响应情况。这一现象充分说明,细胞表型实际上是由细胞内在身份以及外部刺激共同决定的。
随后,该研究深入分析了细胞模块与样本表型之间的关联,揭示出多项重要且有趣的生物学发现。例如,随着年龄的逐渐增长,脾脏中的两个免疫细胞模块CM05和CM06呈现出截然相反的时间动态变化。相应地,组成这些模块的免疫细胞亚群的频率也表现出一致的动态变化。其中,相比于此前报道的年龄相关B细胞(age-associated memory B cells, ABCs),CM05中的细胞亚型随着年龄的增长显示出更明显的变化。进一步的深入分析成功锁定 17 个在 CM05 中发挥关键调控作用的转录因子,这些转录因子的活性呈现出随着年龄增加而一致增强的态势。这些结果表明,在人体衰老这一复杂进程中,分子层面、细胞层面以及多细胞层面之间存在着高度的协调一致性。此外,依托于在乳腺中富集的 CM12,作者成功揭示出一条由成纤维细胞主导的更年期进展轨迹,并发现乳腺中的两类成纤维细胞(S10 和 S06)的频率和炎症特征沿着该轨迹呈现出逐渐下降的趋势。
最后,该研究探究了从健康组织向肿瘤转变过程中多细胞协同模式的动态变化。借助公共数据,该研究构建了一个大规模的泛癌种单细胞图谱,并对具有匹配的健康组织、癌旁组织(作为癌前病变组织的替代)以及肿瘤组织的8种癌症类型进行了系统比较。研究发现,在肿瘤进展过程中,组织特异的健康细胞模块逐渐减弱,而肿瘤相关的细胞模块cCM02逐渐增强。cCM02主要由肿瘤相关的细胞类型组成,而且不同癌症类似共享cCM02。作者从多细胞协同的视角出发,提出了一个肿瘤进展模型:即在组织癌变的过程中,会逐渐丢失各组织特异的健康结构,同时获得跨癌种共同的肿瘤特征,而且不同癌症类型出现趋同的微环境特征。
综上所述,该研究系统阐明了人体健康和疾病组织的多细胞协同模式景观,构建了从细胞表型到组织表型的新桥梁,为细胞调控、组织再生和疾病干预等多个重要领域开辟了新的研究视角,也为大规模数据整合分析建立了新的计算框架。此外,该研究构建的跨组织和泛癌种单细胞图谱为相关领域的未来研究提供了宝贵的数据资源。

北京大学BIOPIC/重庆医科大学张泽民院士和北京大学BIOPIC/生命科学学院博士后石强为该论文的共同通讯作者,北京大学BIOPIC/生命科学学院博士后石强和北京大学前沿交叉学科研究院PTN项目2024级博士生陈奕晗(原北京大学生命科学学院2020级本科生)为该论文的共同第一作者。北京大学BIOPIC副研究员王东方和北京大学BIOPIC副研究员朱琳楠为本研究做出了重要贡献。
论文链接:
https://www.nature.com/articles/s41586-025-09053-4
参考文献
1. Dominguez Conde, C. et al. Cross-tissue immune cell analysis reveals tissue-specific features in humans. Science 376, eabl5197 (2022).
2. Eraslan, G. et al. Single-nucleus cross-tissue molecular reference maps toward understanding disease gene function. Science 376, eabl4290 (2022).
3. Tabula Sapiens, C. et al. The Tabula Sapiens: A multiple-organ, single-cell transcriptomic atlas of humans. Science 376, eabl4896 (2022).
4. Regev, A. et al. The Human Cell Atlas. Elife 6, e27041 (2017).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


