《自然·癌症》:放疗会诱发中性粒细胞组织修复相关反应,促进癌症转移
来源:奇点糕 2022-03-20 21:15
目前,放疗是肿瘤患者最常规且有效的治疗方式之一,约60%癌症患者会接受放疗。随着放疗技术设备及影像技术的更迭,放疗的有效性及可靠性越来越高。尽管如此,放疗过程中对于健康组织的误伤仍然不可避免。组织损伤首先带来炎症反应,但后期就需要启动组织修复。组织修复(再生)需要抑制炎症免疫反应,这跟肿瘤免疫抑制的微环境相似。然而,放射损伤-修复微环境与肿瘤转移之间的关系仍
目前,放疗是肿瘤患者最常规且有效的治疗方式之一,约60%癌症患者会接受放疗。
随着放疗技术设备及影像技术的更迭,放疗的有效性及可靠性越来越高。尽管如此,放疗过程中对于健康组织的误伤仍然不可避免。
组织损伤首先带来炎症反应,但后期就需要启动组织修复。组织修复(再生)需要抑制炎症免疫反应,这跟肿瘤免疫抑制的微环境相似。然而,放射损伤-修复微环境与肿瘤转移之间的关系仍不清楚。
近日,由伦敦玛丽女王大学Ilaria Malanchi领衔的研究团队在《自然?癌症》发表重要研究结果。
他们发现小鼠健康肺部被辐射之后,会导致大量外周循环的中性粒细胞浸润到损伤部位,产生与组织修复相关的中性粒细胞反应,并激活肺上皮细胞Notch信号通路介导的促肿瘤肺转移。用中性粒细胞脱颗粒抑制剂Nexinhib20,或者Notch抑制剂DAPT能够有效抑制中性粒细胞介导的肿瘤转移。
Malanchi团队的前期研究表明,乳腺癌发生肺转移时,肺组织会发生一种组织再生的现象[2]。随后,Malanchi团队分析了以往的基础研究及临床研究数据,结果发现接受放疗的患者,乳腺癌病灶同侧的肺组织肿瘤转移的现象更为常见[3,4]。
因此,Malanchi团队想知道放疗对健康组织的误伤是否可能有助于肿瘤细胞的转移。如果是,他们还想知道背后的分子机制是什么。
为了回答这个假设,Malanchi团队用辐射(单次13Gy)肺部造成的急性肺损伤,结合移植肿瘤细胞的小鼠模型,来探究健康组织损伤与肿瘤转移的关系。
在辐射造成小鼠急性肺损伤后,无论是小鼠原位乳腺移植肿瘤细胞,还是尾静脉直接植入肿瘤细胞,研究人员都发现:移植14-21天后,辐射组小鼠肺部的肿瘤数目、肺组织切片展示的肿瘤面积都急剧增加。
为了排除个体差异,他们精准辐射小鼠右侧肺部造成损伤,随后尾静脉植入肿瘤细胞。实验数据表明,小鼠右侧肺叶的肿瘤数目显着高于未辐照的左侧肺叶。
在辐射造成小鼠急性肺损伤后,Malanchi团队还通过组织切片染色证实辐射的确会带来组织损伤,如DNA的断裂。此外,他们还有个意外发现:进入到损伤肺部的中性粒细胞显着增加,且呈现为多分叶核和颗粒蛋白含量增加的炎症活化型细胞形态。
为了验证浸润的中性粒细胞是否参与促进肿瘤细胞转移到受损组织定殖,Malanchi团队采用一正一反两种策略。
先来看第一种策略。在辐射前一天开始直到实验结束,他们每天给小鼠腹腔注射抗Ly6G抗体,清除小鼠体内的中性粒细胞。在辐射7天后,他们又通过尾静脉注射,给小鼠移植肿瘤细胞。在移植肿瘤细胞7天后,他们发现清除中性粒细胞能够有效抑制转移到肺部肿瘤的生长。
在第二种策略中,他们采用了G-csf(粒细胞刺激因子)敲除小鼠作为肿瘤移植受体鼠。从辐射前一天开始,每隔一天共4次皮下注射外源重组粒细胞刺激因子(rGCSF),给G-csf敲除小鼠补充GCSF。在辐射7天后,进行尾静脉肿瘤细胞移植。在移植肿瘤细胞7天后,他们发现注射rGCSF能够促进肿瘤转移到肺部。
基于以上研究成果,Malanchi团队推测辐射损伤健康肺组织,能够预激活浸润的中性粒细胞,进而改造肺部微环境利于肿瘤细胞转移定殖。
为了验证这种猜想,Malanchi团队设计了一个二次移植实验:先将供体小鼠肺部进行辐射损伤,7天后用抗Ly6G磁珠富集分离出肺部浸润的中性粒细胞。将这些已经预激活的中性粒细胞转移到正常小鼠体内,再通过尾静脉注射肿瘤细胞。
结果显示,移植预激活中性粒细胞的小鼠肺部肿瘤数目显着高于对照组。这个实验结果表明:这群预激活的中性粒细胞具备将肺部微环境改造成有利于肿瘤转移的能力。
为了探究预激活的中性粒细胞影响肺部的具体靶细胞群,Malanchi团队借助抗Ly6G抗体清除中性粒细胞,然后通过流式分选肺上皮细胞(CD45-CD31-Ter119-EpCAM+)、间充质细胞(CD45-CD31-Ter119-EpCAM-),并进行RNA-Seq测序。
主成分聚类分析显示:辐射加注射抗Ly6G抗体实验组的样本与单纯辐照实验组的样本不能够聚类在一起。这表明清除中性粒细胞对辐射处理的肺上皮细胞影响非常大。再结合体外肺类器官培养模型实验,证实了预激活的中性粒细胞能够更好地激活肺上皮细胞。
为了探究预激活的中性粒细胞对肺上皮细胞功能的影响,Malanchi团队深入分析了肺上皮细胞RNA-Seq数据。结果发现肺上皮细胞的Notch信号通路被预激活的中性粒细胞活化。
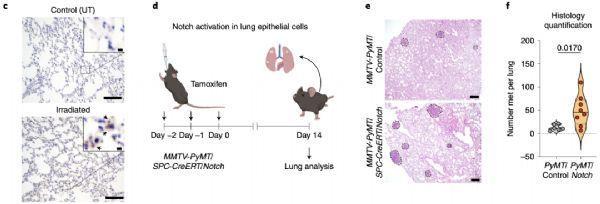
为了了解这群Notch信号通路异常活化的肺上皮细胞是否参与到肿瘤细胞转移中,Malanchi团队构建了他莫昔芬诱导的Notch在II型肺泡细胞特异性过表达的转基因小鼠(Sftpc-CreER; Rosa26NICD-IRES-GFP)。随后让这种小鼠与自发乳腺癌小鼠(MMTV-PyMT)交配,获得能够自发原位乳腺肿瘤,且能被他莫昔芬特异性诱导II型肺泡细胞活化Notch信号通路的小鼠模型。
借助于上述小鼠模型,他们发现Notch过度活化的II型肺泡细胞确实能够促进乳腺癌的肺转移。他们还借助单细胞测序分析证实,辐射后的肺上皮细胞在肿瘤细胞到达之前,Notch信号通路已经被过度活化。
鉴于干细胞转录因子Sox9是Notch1的下游靶基因[5],Malanchi团队想知道在Notch信号通路过度活化微环境中,肿瘤细胞自身的干性是否被增强。他们发现辐射确实促进了Notch信号的传递和转移肿瘤细胞的干细胞化。
那么,故事讲到这个份上,就必须回到本研究的主角中性粒细胞。这群预激活的中性粒细胞又是如何影响到肺上皮细胞的呢?
Malanchi团队根据前面发现的中性粒细胞胞内颗粒蛋白增加现象,猜测有可能是这些颗粒蛋白的释放介导了上述过程?因此,他们提出通过抑制中性粒细胞的脱颗粒过程,来探究颗粒蛋白不再释放是否会影响肿瘤的转移。
他们发现,脱颗粒抑制剂Nexinhib20的确可以逆转辐射损伤肺部由中性粒细胞介导的促肿瘤转移现象。更进一步,他们还采用中性白细胞弹性硬蛋白酶(Ela2)基因敲除小鼠模型,得到了与抑制剂Nexinhib20相同的效果。
那么,如果抑制肺上皮细胞过度活化的Notch信号通路,是否也能够达到逆转辐射损伤肺部由中性粒细胞介导的促肿瘤转移效果呢?
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->