研究发现溶酶体膜蛋白减轻心肌缺血/再灌注损伤的作用和自噬调控新机制
来源:营养与健康所 2020-07-27 08:20
7月23日,Circulation Research在线发表了中国科学院上海营养与健康研究所肿瘤与微环境重点实验室研究员杨黄恬研究组与中山大学中山医学院教授曹楠研究组合作的题为Downregulation of LAPTM4B Contributes to the Impairment of the Autophagic Flux via Unopposed
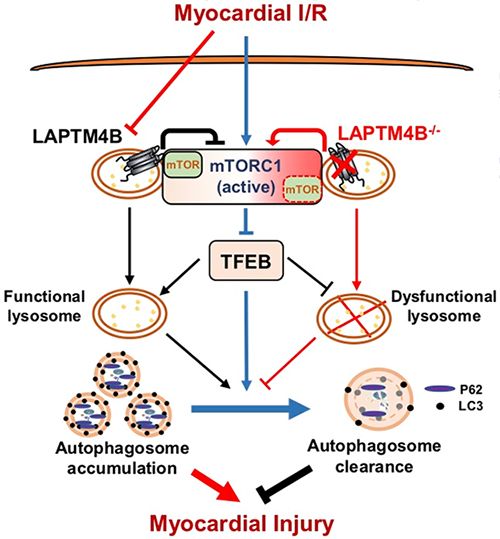
心血管疾病是当今威胁人类健康最严重的疾病之一,而缺血性心肌病是其中最致命的一种。及时进行再灌注是挽救缺血心脏的必需步骤。然而,该过程伴随着严重的再灌注损伤,临床缺乏有效的干预手段,发现新的抵抗心肌I/R损伤的机制具有重要的科学意义和临床需求。近年研究发现自噬这一关键细胞稳态维持系统在I/R损伤中扮演重要角色。在心肌缺血阶段,激活的自噬可以清除诱发心肌细胞死亡的错误折叠蛋白和坏死线粒体等,从而起到心肌保护作用;而在再灌注阶段自噬水平处于过度激活状态,但形成的自噬小体清除障碍,对心肌造成损伤。为何自噬在I/R不同阶段具有相反的作用?其调控靶点和机制是什么?这是领域内长久以来有待阐明的重要科学问题,亦是困扰自噬调控药物临床应用的重要障碍。
研究发现,再灌注阶段心肌细胞中溶酶体的数量和功能明显下降,导致自噬流被部分阻断,心肌细胞对自噬小体的清除能力降低,过量自噬小体的堆积导致心肌细胞大量死亡;同时伴随溶酶体膜蛋白LAPTM4B水平的下调。进一步研究发现,LAPTM4B对溶酶体数量和功能的维持是必须的。LAPTM4B-/-小鼠I/R心肌溶酶体数量进一步减少、自噬小体堆积加重,心肌梗死面积加大;LAPTM4B过表达可以逆转心肌I/R导致的这些表型,但其心肌保护作用可被溶酶体功能抑制剂取消,提示LAPTM4B可通过提升I/R中溶酶体数量和功能减少自噬小体累积,进而发挥心肌保护作用。进一步分析揭示,LAPTM4B可通过其E3区域与mTOR蛋白结合抑制I/R所引起的mTORC1复合物激活,促进溶酶体关键转录因子TFEB的核转位,从而协助溶酶体功能和膜稳定性维持,提升心肌细胞抵抗I/R损伤的能力。
该研究揭示了溶酶体膜蛋白LAPTM4B的下调可通过mTORC1/TFEB通路造成心肌I/R时自噬流受阻,心肌细胞死亡。因此,研究发现揭示了LAPTM4B在心脏的新功能和其调控的mTORC1/TFEB通路在心肌I/R导致的自噬中的重要作用,并提示维持溶酶体功能是对抗心肌I/R损伤的重要一环。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


