开创多个第一,总缓解率100%!新CAR-T疗法获FDA授予两项认定,患者连续6个月无癌
来源:生物探索 2022-12-14 13:25
CAR-T细胞疗法是肿瘤治疗领域当前最热门的疗法之一,相比于传统的治疗方式,其对肿瘤尤其是血液瘤的治疗效果无疑是振奋人心的。
CAR-T细胞疗法是肿瘤治疗领域当前最热门的疗法之一,相比于传统的治疗方式,其对肿瘤尤其是血液瘤的治疗效果无疑是振奋人心的。在这其中,多项临床研究显示靶向B细胞受体相关蛋白CD19的CAR-T细胞疗法,在治疗复发或难治性B细胞恶性肿瘤方面具有很好的效果,尤其在治疗急性B淋巴细胞白血病的临床前及Ⅰ、Ⅱ期临床试验中均显示出了良好的抗肿瘤作用。
非霍奇金淋巴瘤是一大类B细胞恶性肿瘤,约占所有肿瘤的4%,复发或难治性患者的预后较差。B细胞肿瘤复发的常见因素是肿瘤细胞表面抗原CD19的下调和CD19-细胞的增加,靶向CD19和其他B细胞抗原就成为一种较优的治疗选择,以降低抗原免疫逃逸介导的疾病复发风险[1]。
Caribou Biosciences公司旗下的CB-010就是一款抗CD19 CAR-T细胞疗法,其为该公司同种异体CAR-T细胞治疗平台的主要候选产品,目前正在ANTLER阶段对复发或难治性B细胞非霍奇金淋巴瘤(r/r B-NHL)患者进行评估试验。对于CB-010,研究人员使用Cas9 CRISPR chRDNA技术将CD19特异性CAR插入TRAC 基因并敲除PD-1以增强抗肿瘤活性的持久性。
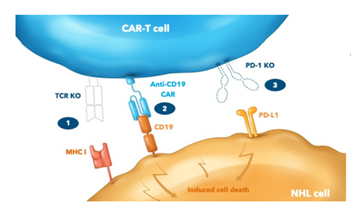
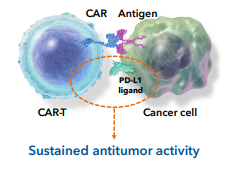
图1 CB-010 CAR-T疗法(图源:Caribou Biosciences)
今年5月,该公司在欧洲血液学协会上公布了该款细胞疗法在治疗r/r B-NHL患者的ANTLER研究Ⅰ期初步结果,6名患者接受了CB-010治疗,5名患者完成了28天的剂量限制毒性评估期,5名患者获得响应,4名患者达到完全缓解,2名患者达到部分缓解,表明其总体缓解率达到100%,完全缓解率达到80%。同时,4名达到完全缓解的患者至少持续了3个月的完全缓解状态。
值得注意的是,这款CAR-T细胞疗法开创了多个第一,CB-010是临床上第一个具有PD-1敲除的同种异体CAR-T细胞疗法,这是CB-010首次在r/r-B-NHL患者中进行的人体试验,CB-010是第一个实现100%总缓解率的同种异体CAR-T细胞疗法。
11月29日,Caribou Biosciences宣布FDA授予其CAR-T细胞疗法CB-010再生医学先进疗法(RMAT)资格,用于治疗复发或难治性大B细胞淋巴瘤(LBCL),同时还授予其快速通道(Fast Track)资格,用于治疗复发或难治性B细胞非霍奇金淋巴瘤(r/r B-NHL)。

图2 公司公告(图源:Caribou Biosciences)
对此,Caribou总裁Rachel Haurwitz博士表示:“CB-010的RMAT和Fast Track指定是对现成细胞疗法治疗侵袭性B-NHL的显著未满足患者需求的重要认可,通过使用精确的CRISPR chRDNA基因组编辑技术进行基因组编辑,CB-010的设计采用了PD-1敲除策略,可通过限制CAR-T细胞过早耗竭来提高抗肿瘤活性的持久性。在我们的ANTLER 1期试验中,6名接受剂量水平1的CB-010治疗的患者中有3名在6个月时保持持久的完全反应。CB-010已经证明了作为一种现成的细胞疗法的早期潜力,可以与自体细胞疗法进行有意义的竞争。”
正如该公司在欧洲血液学协会上介绍的,在接受CB-010治疗后,6名患者中有3名维持了6个月的完全缓解状态,也就是说这3名患者保持了半年的无癌状态,迄今为止,甚至有患者维持无癌状态长达15个月,具有突破性的治疗意义。
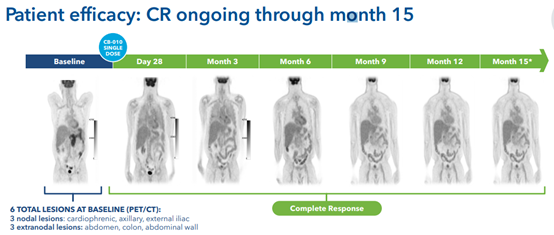
图3 有患者实现保持完全缓解状态长达15个月(图源:Caribou Biosciences)
安全性方面,在接受CB-010治疗后,6名患者中有3名患者出现3级或4级不良事件,包括中性粒细胞减少症(50%)、血小板减少症(33%)、贫血(17%)以及低丙种球蛋白血症(17%)。一名患者出现了1级细胞因子释放综合征(17%)和3级免疫效应细胞相关神经毒性综合征(17%),被鉴定为剂量限制性毒性,接受了治疗后,该名患者在39小时内恢复。该研究表明CB-010在剂量水平为1的r/r B-NHL患者中初步显示出安全性。
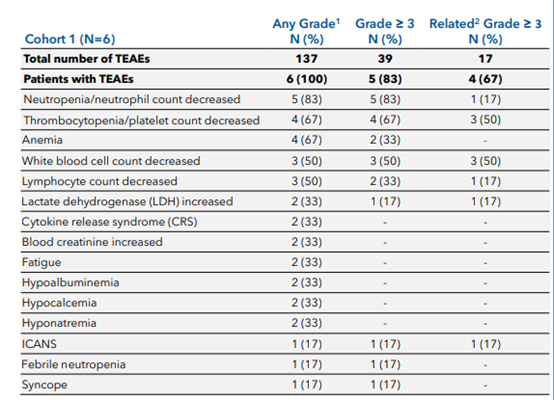
图4 不良反应事件汇总(图源:[2])
截至目前的临床试验显示了CB-010基于剂量水平1(40×106个CAR-T细胞)的有效性和安全性数据,基于剂量水平2(80×106个CAR-T细胞)的临床试验正在招募患者,预计到年底会有更多数据。
除了正处于临床前以及临床阶段的CD19 CAR-T产品,目前全球一共有6款靶向CD19的CAR-T产品获批上市,从临床研究的角度来看CD19 CAR-T细胞疗法疗效优异,但其劣势也很明显,包括安全性不足、价格贵、自体CAR-T制备时间较长。
表1 目前批准上市的CD19 CAR-T产品
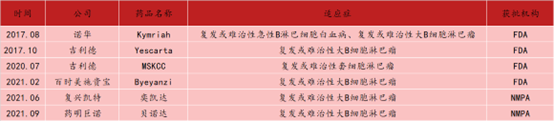
资料来源:[4]丨制表:生物探索团队编辑团队
在安全性方面,CD19 CAR-T产品的使用可能会导致多种副作用出现,比如神经毒性、肿瘤溶解综合征、细胞因子释放综合征、脱靶效应;在价格方面,Kymriah定价高达47.5万美元,Yescarta定价达37.3万美元,不仅削弱了药物可及性也使得其商业化之路不顺利;制备时间较长使得有些患者在等待治疗的过程中离世。
为了提高CD19 CAR-T产品的抗肿瘤效应,研究人员提出了多种策略,比如“Armoured”CAR-T、双靶点或多靶点CAR-T/Nb CAR-T、联用免疫检查点阻断剂。期待随着科研技术的进一步发展,CD19 CAR-T细胞产品的各项劣势可以有所弥补,使得CAR-T产品可以惠及更多肿瘤患者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


