Nat Commun:从“谈癌色变”到“免疫反击” 新型合成mRNA或有望为抗癌带来新希望
来源:生物谷原创 2025-03-20 12:08
本文研究不仅为癌症治疗提供了新的思路,还为未来的免疫疗法研究奠定了坚实的基础;研究人员期待这种新型s-mRNA疗法能够在未来的临床试验中取得更多突破,为癌症患者带来更长久、更健康的生存希望。
癌症,这个令人闻风丧胆的名词,一直是全球健康领域的重大挑战。尽管医学技术不断进步,但癌症的转移仍然是导致患者死亡的主要原因。一旦癌细胞从原发肿瘤扩散到其他器官,传统的手术、放疗和化疗等手段往往效果大打折扣。
然而,近日,一篇发表在国际杂志Nature Communications上题为“Synthetic short mRNA prevents metastasis via innate-adaptive immunity”的研究报告中,来自日本信州大学医学院等机构的科学家们通过研究开发出了一种新型合成mRNA,其能够激活机体免疫系统的功能,并能识别和攻击正在转移的癌细胞,这一突破性的成果有望为提高癌症患者的生存率开辟新途径。
癌症转移是一个极其复杂的过程,其主要涉及癌细胞、免疫细胞和周围组织的相互作用。癌细胞为了在体内扩散,会采用多种策略来抑制免疫系统,使原本应该攻击肿瘤的自然杀伤细胞(NK细胞)和细胞毒性T淋巴细胞(CTLs)被重新编程,从而营造出免疫抑制的环境。在这种环境下,免疫细胞不仅功能失调,还可能变得“疲惫”,这样就会失去有效杀伤癌细胞的能力。
文章中,研究者Sachie Hiratsuka等人通过研究开发出了一种基于IL1β-mRNA的合成mRNA(s-mRNA),这种s-mRNA能通过静脉注射进入体内并激活免疫细胞,从而增强其对转移癌细胞的攻击能力。这种s-mRNA的设计灵感来源于研究人员在小鼠肺部发现的全长IL1β-mRNA,这种mRNA能够通过与NK细胞上的RNA结合蛋白ZC3H12D结合来激活免疫细胞。然而天然的IL1β-mRNA在体内很容易被RNase(一种分解RNA分子的酶)降解。为了克服这一问题,研究人员设计了一种更短的合成IL1β-mRNA,并对其进行了化学修饰,使其能够在小鼠和人类血清中稳定存在长达48小时。
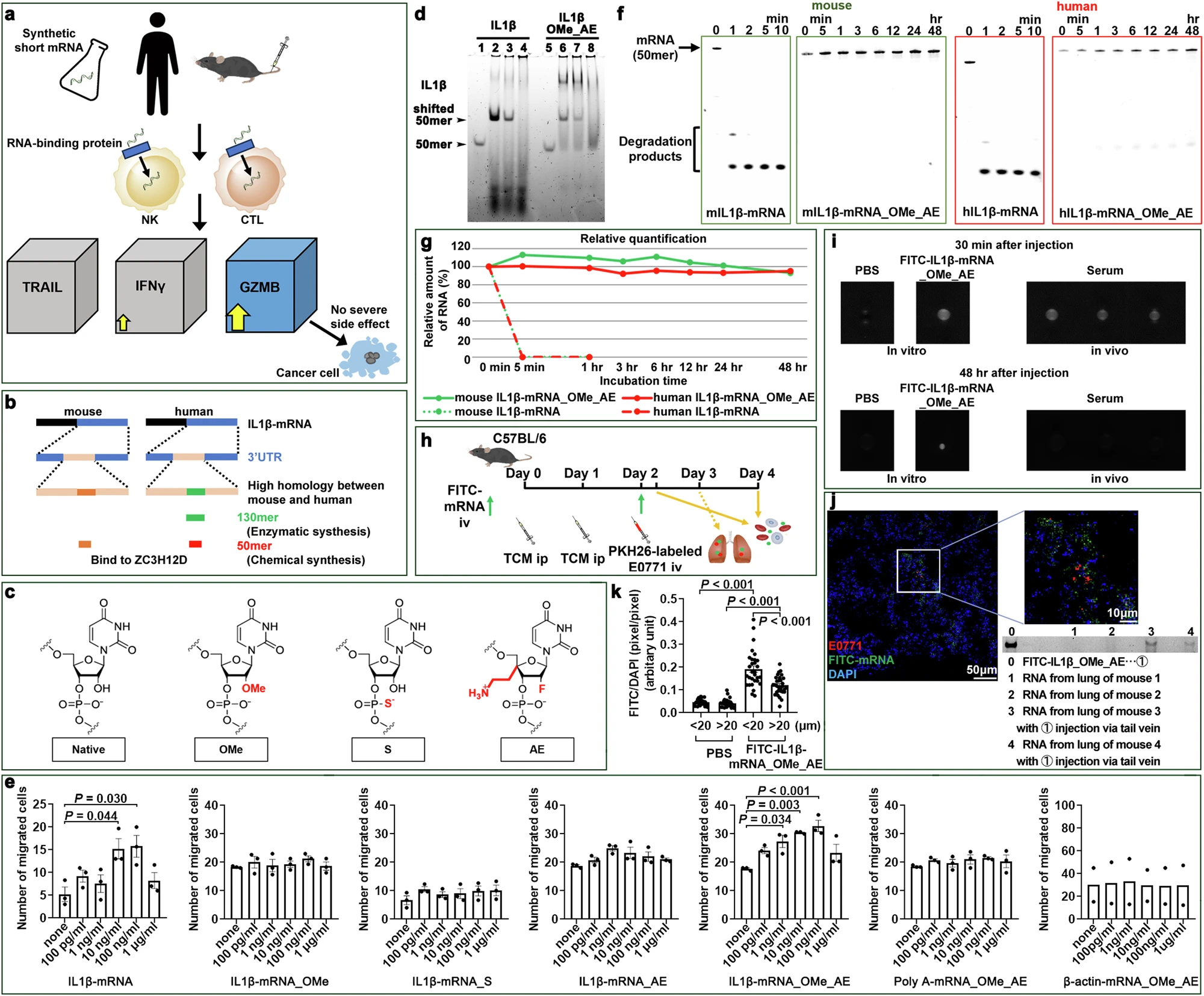
功能性合成短IL1β-mRNA(s-mRNA)序列及其在携带肿瘤状态下的稳定性
当这种s-mRNA通过静脉注射进入体内后,其就会结合到NK细胞和CTLs上并进入细胞核,进而触发一种名为GZMB的关键分子的产生,这种分子对于杀伤肿瘤细胞至关重要。更重要的是,这一过程不会引发细胞因子风暴,细胞因子风暴是一种免疫系统的过度反应,其可能会对身体造成严重伤害。为了验证s-mRNA的有效性,研究人员在携带肿瘤的小鼠身上进行了实验,他们将乳腺癌(E0771)和结肠癌(MC-38)细胞植入小鼠体内模拟原发肿瘤,并通过向血液中注射癌细胞来刺激转移,实验结果表明,仅需三次小剂量(每次1微克)的s-mRNA注射就能显著减少小鼠肺部的转移细胞数量。
令人惊讶的是,接受s-mRNA治疗的小鼠在手术后模拟转移的模型中,21天后机体肺部的转移灶数量显著减少,这就表明,即使在手术切除原发肿瘤后,s-mRNA仍能有效抑制癌细胞的转移。这种s-mRNA不仅在动物实验中表现出色,还在人类患者身上展现了巨大的潜力,随后研究人员将s-mRNA注入从结肠癌患者体内提取的免疫细胞中,这些细胞在抗癌药物治疗或多种癌症的环境下往往功能减弱;然而s-mRNA成功重新激活了这些免疫细胞,使其能杀死高达70%的癌细胞。与已知的免疫细胞刺激因子IL-12相比,s-mRNA在激活免疫细胞方面表现更为出色。此外s-mRNA治疗还能与其它疗法(如抗PD-1抗体)联合使用进一步提高治疗疗效。
研究者指出,s-mRNA治疗不仅安全、易于给药,而且对转移癌细胞具有显著的杀伤效果;更重要的是,这种疗法能多次给药且不会引发不希望的炎症副作用,这就为那些传统癌症治疗效果不佳的患者带来了新的希望。随着癌症发病率的不断上升,转移性癌症的治疗一直是医学界的难题;本文研究不仅为癌症治疗提供了新的思路,还为未来的免疫疗法研究奠定了坚实的基础;研究人员期待这种新型s-mRNA疗法能够在未来的临床试验中取得更多突破,为癌症患者带来更长久、更健康的生存希望。(生物谷Bioon.com)
参考文献:
Hayashi, H., Seki, S., Tomita, T. et al. Synthetic short mRNA prevents metastasis via innate-adaptive immunity. Nat Commun 16, 1925 (2025). doi:10.1038/s41467-025-57123-y
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


