Leukemia:发现恶性血液肿瘤治疗新靶点
来源:合肥研究院 2022-02-11 16:39
近日,中国科学院合肥物质科学研究院健康与医学技术研究所研究员刘青松团队与美国哈佛大学医学院Dana-Farber癌症研究所教授James Griffin团队合作,发现了针对EZH2突变阳性恶性血液肿瘤的治疗新靶点USP47。相关研究成果在线发表于Leukemia。在恶性血液肿瘤,如生发中心弥漫大B淋巴瘤(GCB- DLBCL)、滤泡性
近日,中国科学院合肥物质科学研究院健康与医学技术研究所研究员刘青松团队与美国哈佛大学医学院Dana-Farber癌症研究所教授James Griffin团队合作,发现了针对EZH2突变阳性恶性血液肿瘤的治疗新靶点USP47。相关研究成果在线发表于Leukemia。
在恶性血液肿瘤,如生发中心弥漫大B淋巴瘤(GCB- DLBCL)、滤泡性B细胞淋巴瘤(FL)、急性髓系白血病(AML)中,分别大约有22%-24%、10%和1%的患者携带EZH2-Y641位点突变。该突变一方面可导致组蛋白甲基转移酶EZH2高度活化,催化组蛋白H3在赖氨酸27位的三甲基化修饰(H3K27me3)来介导基因沉默;另一方面通过影响EZH2的转录因子活性来调节下游信号通路,最终导致恶性血液肿瘤的异常增殖和进展。因而单纯使用EZH2甲基转移酶活性抑制剂不能起到较好的抑制肿瘤生长的疗效,且长期用药易导致二次突变引起耐药、增加不良预后,这也是弥漫大B淋巴瘤等对近期获批或在临床试验中EZH2抑制剂响应率低或耐药的主要原因。因此,针对EZH2突变型的恶性血液肿瘤开发新型治疗策略具有重要临床意义。
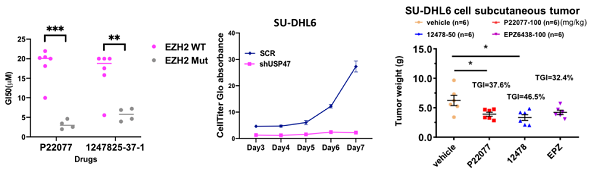
该工作中,研究人员通过高通量筛选发现结构相近的两个化合物P22077和1247825-37-1,可以选择性抑制EZH2-Y641C突变的AML细胞系增殖,并且能够选择性降解EZH2-Y641C蛋白而对野生型没有作用,这种选择性抑制和降解作用在更具有临床治疗意义的突变型DLBCL细胞中也得到了验证。通过多组学分析研究发现,这两个化合物抑制了去泛素化酶USP47的酶活,影响了突变EZH2蛋白的泛素化水平,进而导致突变型EZH2的降解,破坏EZH2相关信号通路的活化。此外,通过基因编辑等分子生物学技术研究发现,USP47在EZH2突变型DLBCL中高表达,更倾向于和突变型EZH2结合,从而增加其蛋白稳定性。酶活抑制和基因沉默USP47均能够有效抑制DLBCL细胞系的增殖,而对正常人外周血细胞(PBMC)没有明显作用。在原代病人细胞以及动物肿瘤模型上的药效评价结果显示,USP47抑制剂能够有效诱导原代病人细胞内突变型EZH2蛋白的降解以及细胞的死亡,从而抑制肿瘤生长。该研究结果表明,靶向USP47是针对EZH2突变的恶性血液肿瘤的潜在治疗手段。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


