Mol Cancer: 科学家们揭示了转移性胃癌的新机制
来源:网络 2023-11-27 13:08
胃癌(GC)转移的可靶向分子驱动因素在很大程度上仍然未知,导致晚期胃癌的靶向治疗选择有限,所以确定转移的分子驱动因素并制定相应的治疗策略是非常迫切的。
胃癌(GC)转移的可靶向分子驱动因素在很大程度上仍然未知,导致晚期胃癌的靶向治疗选择有限,所以确定转移的分子驱动因素并制定相应的治疗策略是非常迫切的。

图片来源:https://doi.org/10.1186/s12943-023-01857-0
近日,来自江原大学的研究者们在Mol Cancer.杂志上发表了题为“Combined inhibition of Bcl-2 family members and YAP induces synthetic lethality in metastatic gastric cancer with RASA1 and NF2 deficiency”的文章,该研究揭示了YAP和Bcl - 2家族成员之间复杂的相互作用,这可能导致合成致命性,为克服耐药性提供了一种潜在的策略。重要的是,本研究结果支持一种个性化的医学方法,即针对NF2和RASA1状态的YAP和Bcl - 2的联合治疗可以有效地管理转移性GC。
研究者使用基因工程GC小鼠模型在腹膜传播中进行了无偏倚的体内全基因组CRISPR/Cas9敲除(KO)筛选。候选基因通过KO细胞的体内移植试验进行验证。研究者使用免疫组织化学分析了GC临床样本中的靶表达模式。通过敲低、KO和过表达的方法,在肿瘤球和类器官实验中研究了靶基因的功能贡献。体外和体内测试了针对Bcl‑2成员和YAP的小化学抑制剂。
研究者通过筛选确定Nf2和Rasa1为转移抑制基因。在临床上,RASA1突变和低NF2表达定义了一种具有侵袭性特征的转移性GC的独特分子亚型。NF2和RASA1缺乏通过协同扩增肿瘤干细胞(CSCs)中的Wnt和YAP信号,增加体内转移和体外肿瘤球形成。
NF2缺乏增强了Bcl - 2介导的Wnt信号,使CSCs对YAP抑制产生抗性。这种耐药性通过同时抑制YAP和Bcl‑2实现的合成致死性被抵消。RASA1缺陷通过Bcl - xL放大Wnt通路,导致癌症的发生。RASA1突变产生了对Bcl - xL抑制的易感性,但额外的NF2缺失由于YAP激活而赋予了对Bcl - xL抑制的抗性。联合抑制Bcl - xL和YAP可协同抑制RASA1和NF2共缺乏症患者的肿瘤发生和体内转移。
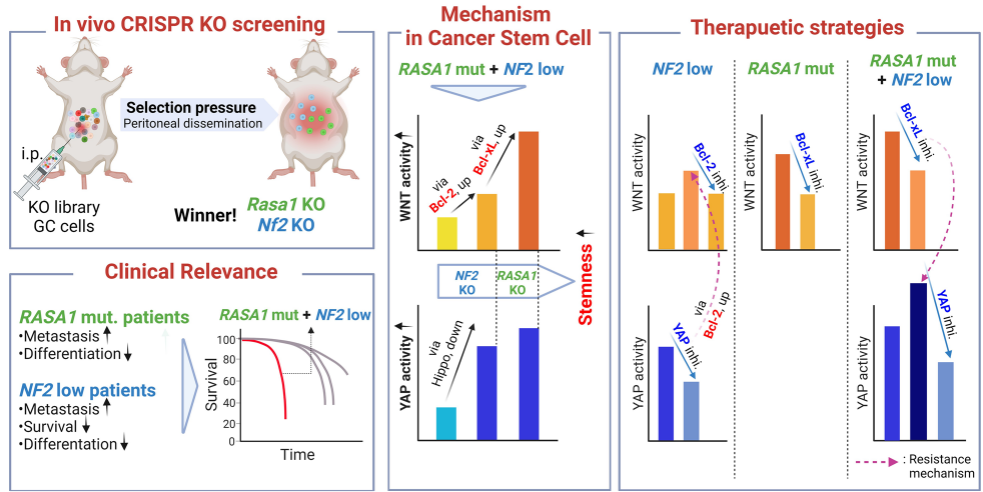
本研究的方法学、临床相关性、潜在机制和治疗意义的示意图
图片来源:https://doi.org/10.1186/s12943-023-01857-0
综上所述,该研究揭示了由RASA1突变和Nf2缺乏驱动的胃癌转移的分子机制,并提出了一种新的治疗策略,即联合抑制Bcl-2家族成员和YAP治疗高转移性胃癌。研究结果为进一步研究确定该方法的临床相关性和适用性提供了坚实的基础。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


