Cell Chem Bio:新型抗生素可治疗耐药性结核杆菌感染
来源:本站原创 2021-04-11 01:33
结核分枝杆菌的抗药性突变会对影响有效疗法的开发。在最近发表在《Cell Chemical Biology》杂志上的一项研究中,来自瑞典Karolinska Institutet的Robert Schnell团队评估了针对分枝杆菌细胞壁重塑的单环β-内酰胺化合物的杀菌效果。
2021年4月11日讯/生物谷BIOON/---结核分枝杆菌的抗药性突变会对影响有效疗法的开发。在最近发表在《Cell Chemical Biology》杂志上的一项研究中,来自瑞典Karolinska Institutet的Robert Schnell团队评估了针对分枝杆菌细胞壁重塑的单环β-内酰胺化合物的杀菌效果。

(图片来源:www.cell.com)
通过针对L.D-转肽酶-2(LdtMt2, 结核分枝杆菌的有效靶标)进行设计,作者合成和表征了一系列新型N-硫代-β-内酰胺。生化分析评估了这些候选药物,并从中确定了五种化合物,它们具有与美洛培南相同或更高的靶标特异性动力学常数。质谱结合晶体学结构共同表明上述五个N-硫代-β-内酰胺类化合物通过一种非常规的方式起作用,即将硫残基从内酰胺环转移到LdtMt2的活性位半胱氨酸,进而导致靶蛋白的长期失活。最后,在体外针对结核分枝杆菌的药物敏感性和多重耐药临床分离株中评估了上述候选药物,从而证实了这些新型化合物杀伤分枝杆菌的作用。
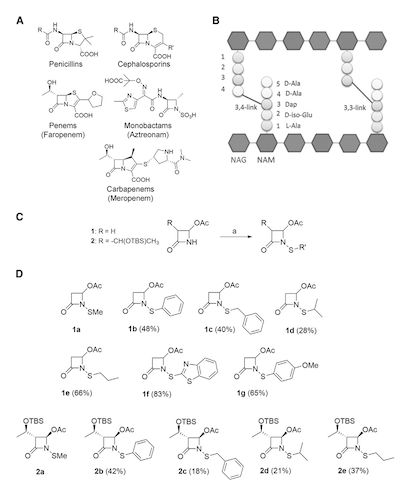
(图1,N-硫代-β-内酰胺类抑制剂的合成与表征)
法罗培南是迄今为止最有效的靶向LdtMt2的β-内酰胺类抑制剂,它在活性位点半胱氨酸上形成小的共价加合物,因此表明其他类似机制或导致形成小的加合物的β-内酰胺化合物可能是有效的候选物。在该研究中,作者设计并合成了12种N-烷硫基和N-芳硫基氮杂环丁烷酮。
为了评估上述药物的靶向特异性结,作者采用了基于分光光度法二硫代硝基苯甲酸酯(DTNB)的检测方法。LdtMt2的BC结构域包含一个半胱氨酸残基,即活性位点Cys354,可与β-内酰胺化合物形成共价加合物。与包含三个结构域的酶的完整片段相比,包含免疫球蛋白样结构域(B)和催化结构域(C)的该两个结构域片段(BC模块)的结构没有显示出显著差异。

由于质谱数据表明LdtMt2与有效的N-硫代-β-内酰胺化合物形成了新型的加合物,因此作者开始了进一步的研究以获得有关LdtMt2的加合物封闭状态的结构信息。通过使预先形成的蛋白质-加合物复合物结晶,分别得到了1.45Å和1.85Å分辨率下X射线衍射数据,进而确定了蛋白质-加合物复合物的结构。晶体属于P21晶体形式,在晶体不对称单元(ASU)中具有两条多肽链,具有基本上相同的构型,在活性位点裂口和覆盖活性位点的活动盖结构域中有序残基。观察到的唯一无序区域是在盖子模块尖端的衍生加合物的结构中,包括三个残基长的片段(残基308-310)。LdtMt2催化位点位于一个β-折叠平台上,该平台在包含残留物303-323的活动盖模块下方存在催化二元组(Cys354,His336)。 β-sheet模块存在多种不同多种构型,包括在TNB加合物(PDB:5LB1)中观察到的全开,在美罗培南加合物结构(PDB:4GSU)中观察到的半开,或在Faropenem-中闭合。

(图2,N-硫代-β-内酰胺与底物结合的结构解析)
活性位点的半胱氨酸SH亲核试剂可在三个位置攻击N-硫代-β-内酰胺。对羰基的攻击导致开环反应,导致硫酯加合物的形成,代表了β-内酰胺类抗生素对细菌转肽酶的经典抑制途径。在包括美罗培南和法罗培南在内的几种β-内酰胺的情况下,也观察到了这种作用机制对LdtMt2的影响。 Cys354-SH亲核试剂对甲基的攻击会导致烷基化反应;但是,它仅限于氧化程度更高的硫衍生物,例如硫酸二甲酯。另外,Cys354-SH亲核试剂攻击硫原子,导致混合的二硫键加合物;与C–N(184 kcal / mol,路径A)或C–S(167 kcal / mol,路径B)相比,该路径涉及最弱的N–S键(111 kcal / mol)的破坏。此外,遵循硬性和软性概念,诸如半胱氨酸依赖性酶之类的软-SH亲核试剂与诸如甲硫醚之类的亲电子试剂之间可获得更有利的相互作用。
结构分析和质谱分析的结果一致性表明特定催化反应以及由此形成的混合二硫化物。 据报道,另一类化合物异噻唑酮在抑制半胱氨酸蛋白酶组织蛋白酶B和组蛋白乙酰转移酶P300 / CBP相关因子中具有相似的机制。 LdtMt2催化的转肽反应开始于对细胞壁肽茎Dap羰基残基的亲核攻击,释放D-Ala残基。N-硫代-β-内酰胺的对接可能会将其S基团置于一个有利位置,以防止Cys354在活性部位发生亲核攻击。 生成的混合二硫键是稳定的修饰,通过阻断催化机制并阻塞底物结合腔,导致酶的不可逆失活。
最后,作者选择N-硫代-β-内酰胺化合物1a,1b,1e,1g和2a对结核分枝杆菌的药物敏感临床分离株进行生长抑制的初步测试。结果显示,化合物1e,1b和1g在20μg/ mL浓度下抑制了结核分枝杆菌的药物敏感性临床分离株的生长。长期以来,人们一直认为β-内酰胺抗菌药物在结核分枝杆菌中的应用受到限制,是由于广谱分枝杆菌A类β-内酰胺酶(BlaC)的快速水解。在克拉维酸存在下,对氨苄西林,阿莫西林和头孢菌素的药敏试验显示MIC值> 16μg/ mL,仍低于血清中可达到的浓度。相比之下,在厌氧培养中,美罗培南-克拉维酸组合对敏感和广泛耐药菌株(MIC <1μg/ mL)的活性也很强。本研究显示:克拉维酸存在下美罗培南的MIC导致H37Rv为32μg/ mL,药物敏感分离株为8μg/ mL,两个MDR分离株MDR-1和MDR-2为8μg/ mL,这些数据与文献数据一致。
克拉维酸-美罗培南的体外杀菌活性已得到充分证实,表明结核分枝杆菌对该组合的敏感性(MIC范围为0.125–32μg/ mL)与对一线或二线抗结核药物的耐药水平无关。但是,美罗培南-克拉维酸的给药困难是将其用作结核病替代疗法的主要障碍。与此不同,法罗培南是一种稳定且可口服的β-内酰胺,即使在不存在克拉维酸盐的情况下也能有效杀死结核分枝杆菌,其MIC值为1.3μg/ mL。本文表征的N-硫代-β-内酰胺化合物对经验证的β-内酰胺靶标LdtMt2具有确定的作用机理。最有效的化合物之一1e表现出对药物敏感的活性以及对结核分枝杆菌的MDR分离物的活性,MIC为20μg/ mL,表明N-硫代-β-内酰胺类可能代表建立了针对未来耐多药结核病的抗生素开发的靶标特异性作用和作用机制。(生物谷 Bioon.com)
原始出处:Giulia Martelli, Tomas Bohn Pessatti, Eva Maria Steiner et al., N-Thio-β-lactams targeting L,D-transpeptidase-2, with activity against drug-resistant strains of Mycobacterium tuberculosis. Cell Chemical Biology.(2021).DOI:https://doi.org/10.1016/j.chembiol.2021.03.008
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


