科研人员发现清除错误折叠蛋白质聚集体的内质网自噬通路
来源:生物物理所 2023-11-08 09:31
内质网是真核细胞中分布最广泛的细胞器,是分泌蛋白和膜蛋白折叠、加工的主要场所。内质网自噬(ER-phagy)是溶酶体对内质网的降解,对蛋白质质量控制以及维持内质网新陈代谢和生理功能至关重要。
内质网是真核细胞中分布最广泛的细胞器,是分泌蛋白和膜蛋白折叠、加工的主要场所。内质网自噬(ER-phagy)是溶酶体对内质网的降解,对蛋白质质量控制以及维持内质网新陈代谢和生理功能至关重要。溶酶体降解内质网的现象在半个世纪前便有报道,但直至2015年内质网自噬受体的发现才最终确认内质网自噬是一个选择性降解的进程而非溶酶体对细胞内容物无差别的降解。内质网自噬受体是一类内质网上的膜蛋白,利用其胞质区域将破损的内质网靶向溶酶体自噬机器。然而,它们往往不具有内质网腔内部分,无法直接感知内质网腔内部的信号,因而只能作为内质网自噬的“执行分子”。那么,激活内质网自噬的上游信号是什么?如何激活内质网自噬?内质网自噬是在内质网的什么特定区域发生?这些均是尚未阐明却颇为重要的科学问题。
中国科学院生物物理研究所王志珍院士团队在《发育细胞》(Developmental Cell)上,在线发表了题为V-ATPase recruitment to ER exit sites switches COPII-mediated transport to lysosomal degradation的研究文章。该研究发现对内质网到高尔基体转运的抑制是一种特异性激活内质网自噬的信号,通过激活V-ATPase-ATG16L1-LC3C轴在内质网输出位点(ER exit site,ERES)启动内质网自噬。
α1-Antitrypsin(AAT)是一种由肝细胞合成后分泌进入循环系统的细胞因子,保护肺组织免受蛋白酶攻击。遗传突变E342K(Z-AAT)引起蛋白质错误折叠,形成累积在内质网无法分泌的聚集体,是肺气肿、肝硬化等疾病的高风险因素。研究发现,在肝来源HepG2细胞中Z-AAT蛋白质聚集体被招募进入ERES,抑制COPII介导的内质网到高尔基体的转运,激活内质网自噬降解错误折叠蛋白质。这一进程依赖LC3脂化修饰反应,却不需要经典自噬标志性的双层膜自噬体,是一种全新的内质网自噬通路。
研究进一步解析了这一通路的分子机制。Z-AAT累积抑制了内质网-高尔基体转运,V-ATPase(定位在高尔基体、内体、溶酶体和质膜上重要的质子泵)的V0亚基滞留在ERES,与胞质中的V1亚基组装形成异常定位在ERES的V-ATPase。V-ATPase招募ATG16L1,特异性介导LC3C在ERES的内质网膜上发生原位的脂化修饰。脂化的LC3C进一步招募内质网自噬的“执行分子”FAM134B-II(肝细胞特异表达的一种内质网自噬受体形式),由后者启动Z-AAT的溶酶体降解。表达Sar1A GTP酶缺陷突变体H79G或Brefeldin A处理都是抑制内质网-高尔基体转运的经典策略,分别激活了V-ATPase-ATG16L1-LC3C轴介导的内质网自噬,表明内质网到高尔基体转运的缺陷确实是一种特异性激活内质网自噬的信号。
该研究鉴定了全新的内质网自噬通路,揭示了细胞ERES从蛋白质转运向溶酶体降解的功能转换,为内质网质量控制系统提供了新认识,并报道了V-ATPase能够在酸性细胞器和质膜以外发挥新功能。
研究工作得到国家自然科学基金、国家重点研发计划、中国科学院战略性先导科技专项和中国科学院稳定支持基础研究领域青年团队计划的支持。
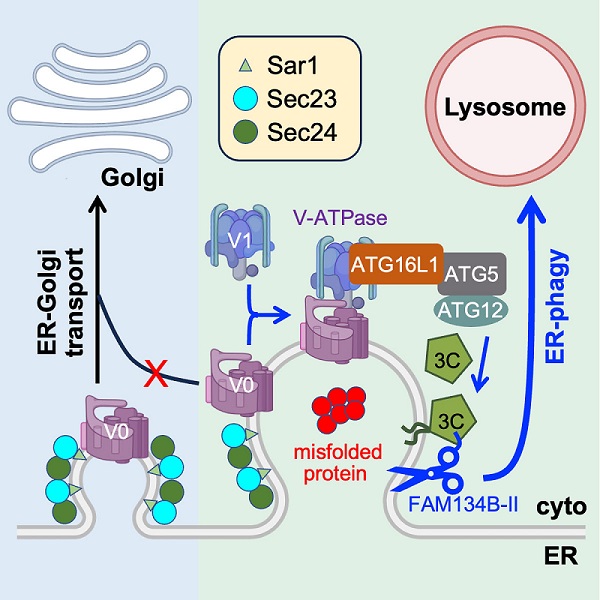
错误折叠蛋白质的累积抑制蛋白质转运激活内质网自噬
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


