Science:靶向SARS-CoV-2刺突蛋白的抗体组合可阻止单一抗体治疗时快速产生的逃逸突变
来源:本站原创 2020-06-25 12:08
2020年6月25日讯/生物谷BIOON/---对抗COVID19大流行的一个有希望的方法是开发靶向SARS-CoV-2的刺突蛋白(S蛋白)的抗病毒抗体。S蛋白是病毒感染力的关键媒介,通过结合ACE2受体进入靶细胞。任何抗病毒治疗的一个重要关注点是由于病毒病原体的快速突变而获得耐药性的可能性。当在药物治疗的环境中施加选择性压力时,这种耐药性变得更加明显。比如
2020年6月25日讯/生物谷BIOON/---对抗COVID19大流行的一个有希望的方法是开发靶向SARS-CoV-2病毒的刺突蛋白(S蛋白)的抗病毒抗体。S蛋白是病毒感染力的关键中介物,通过结合ACE2受体让病毒进入靶细胞。任何抗病毒治疗的一个重要关注点是由于病毒病原体的快速突变而可能获得抵抗性。当在药物治疗的环境中施加选择性压力时,这种抵抗性变得更加明显。比如,最初单独使用一种HIV药物时,这类药物选择性突变导致了广泛的抵抗性。随后HIV药物联合治疗的成功表明,要求病毒在多个遗传位点同时发生突变可能是避免治疗抵抗性的最有效方法。
科学家们最近利用基因人源化的小鼠和来自恢复期患者的B细胞,产生了一个非常大的靶向SARS-CoV-2 S蛋白的受体结合结构域(RBD)的高强效全人中和抗体的集合。产生这个非常大的集合的预期目标是筛选成对可以同时结合S蛋白的RBD的高强效抗体,因此它们可能构成治疗性的抗体混合物,不仅可以成为一种有效的治疗,而且也可能防止为了应对单一抗体治疗的选择性压力而产生的病毒逃逸突变体引起的抗体抵抗性。
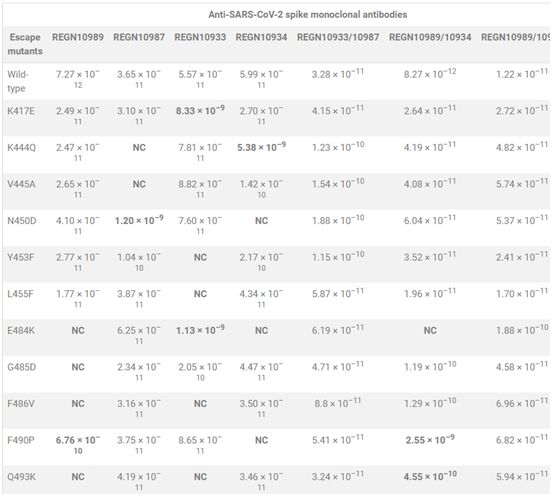
在一项新的研究中,为了评估再生元制药公司(Regeneron Pharmaceuticals)近期描述的抗病毒抗体对截至2020年3月底已确定的可公开获得的SARS-CoV-2序列(代表超过7000个独特的基因组)所代表的一系列S蛋白RBD突变体的有效性,该公司的研究人员使用了表达这些SARS-CoV-2 S蛋白突变体的VSV假颗粒系统。他们的前八种中和抗体都可有效地抵抗所有测试的突变体(表1),从而展示了对在人类中传播的SARS-CoV-2的广泛覆盖。相关研究结果于2020年6月15日在线发表在Science期刊上,论文标题为“Antibody cocktail to SARS-CoV-2 spike protein prevents rapid mutational escape seen with individual antibodies”。

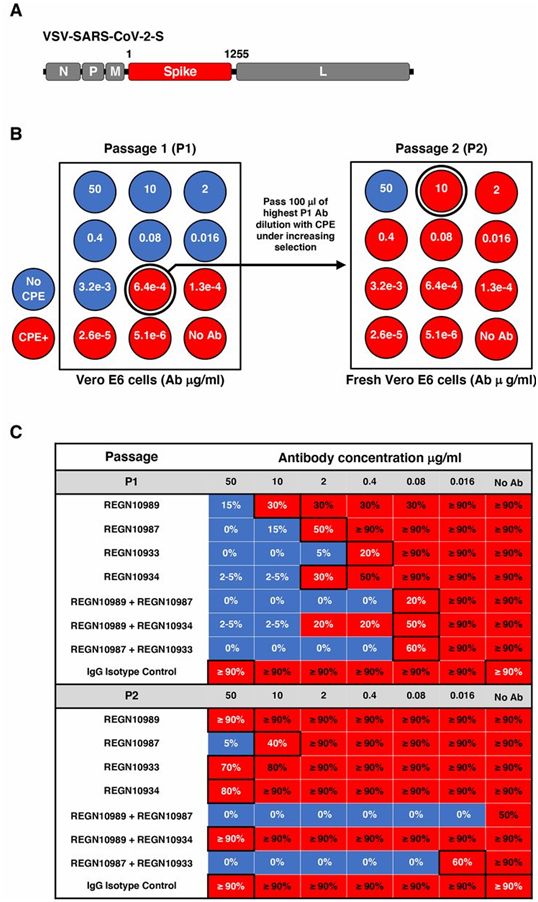
接下来,通过使用复制性的VSV-SARS-CoV-2-S病毒(图1A),在单一抗体和抗体组合的压力下选择逃逸突变体。在第一次传代时,针对4种抗体中的每一种,他们迅速确定了多种独立的逃逸突变体(图1,B和C,和图2)。在第二次传代时,这些突变体中的一些很容易在病毒群体中固定下来,对高达50ug/ml的抗体浓度产生抵抗力。对逃逸突变体的测序(图2)显示,单个氨基酸的变化可以破坏经筛选后广泛抵抗所有已知的RBD突变体的抗体的结合。
接下来,这些研究人员评估了用他们之前描述的抗体组合(REGN10987+REGN10933)处理后的逃逸突变情况,这种抗体组合的合理设计是通过包含两种抗体来避免逃逸突变,这两种抗体结合RBD的不同的非重叠区域,因此可以同时结合和阻断RBD功能。在这种抗体组合的存在下培养VSV-SARS-CoV-2-S病毒,并没有导致逃逸突变体的产生(表2,图1,B和C,以及图2)。因此,这种选择的抗体组合并没有快速导致逃逸突变体产生,这大概是因为逃逸突变需要病毒在两个不同的遗传位点同时发生突变的可能性不大,从而破坏这种抗体组合中两种抗体的结合和中和。
除了上述抗体组合之外,他们还评估了用其他的抗体组合物(REGN10989+REGN10934和REGN10989+REGN10987)处理后的逃逸突变情况,这次由完全或部分竞争结合RBD的抗体组成---两种抗体结合到RBD上的区域存在重叠。在这些抗体组合处理的选择压力下,对一种组合有抵抗性的逃逸突变体迅速产生,但对另一种组合没有抵抗性(表2,图1,B和C,以及图2)。对于一种各组分表现出完全竞争的抗体组合(REGN10989+REGN10934),一个氨基酸替换就足以破坏这种抗体组合的中和作用,从而证实这两种抗体都需要与E484残基结合才能中和SARS-CoV-2。有趣的是,这种快速逃逸并没有发生在另一种不同的各组分只表现出部分竞争的抗体组合(REGN10989+REGN10987)中;当REGN10989事先结合时,REGN10987可以较弱地与RBD结合。因此,即使是不选择同时结合的抗体组合,也可能有时会阻止逃逸突变产生,这是因为它们的表位只有部分重叠,或者因为可导致逃逸的残基不容易被这种病毒耐受,因此不容易被选择。
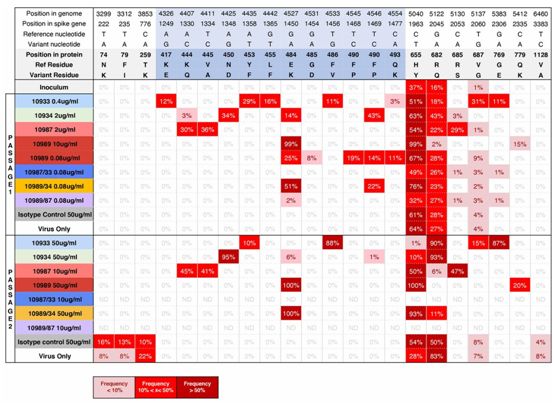
为了从功能上证实通过测序检测到的这些S蛋白突变是SARS-CoV-2抗体中和能力丧失的原因,他们构建出表达单个确定的S蛋白突变的VSV-SARS-CoV-2刺突假颗粒。将这些假颗粒用于单一抗体处理和抗体组合处理的中和试验,并计算IC50值(表2)。正如预期的那样,携带在四种单一抗体以及REGN10989+REGN10934竞争性抗体组合的存在下进行病毒传代时选择的氨基酸突变的假颗粒,足以完全消除或大大降低这些处理在这些试验中的中和能力。在两种抗体处理后产生的病毒群体中,在早期传代时低频检测到的单逃突变体(如REGN10934和REGN10987处理后产生的突变K444Q),在其中一种抗体(REGN10987)存在下的后期传代时固定下来,从而能够破坏这两种抗体组合使用时的中和能力。这表明抗体可以驱动病毒在不同的方向进化和逃逸。然而,如果两种抗体具有部分重叠的结合表位,那么由一种抗体导致的逃逸突变体在病毒群体中固定下来,会导致另一种抗体的活性丧失,这凸显了广泛使用单一抗体治疗的风险。重要的是,REN10987+REGN10933抗体组合---由两种可以同时结合RBD上的两个独立表位的抗体组成---保留了中和所有已发现的RBD突变体的能力。
众所周知,RNA病毒会随着时间的推移而积累突变,任何抗病毒治疗的一个重要关注点是可能选择治疗诱导的逃逸突变体。一种防止逃避抗体治疗的常见策略涉及选择结合到保守表位的抗体,然而这种策略可能是不够的。虽然可以根据序列和结构分析对表位的保守性进行一些有依据的分析,但在强大的选择压力下,逃逸的可能性仍然存在。事实上,用抗流感病毒血凝素主干(hemagglutinin stem)结合抗体进行的逃逸研究表明,尽管不同流感亚型之间的血凝素主干表位高度保守,但仍可能出现逃逸突变体,一些逃逸突变产生在抗体表位区域的外面。在多种冠状病毒中表现出广泛中和能力因而可能靶向更多保守性残基的抗体尚未显示出在选择压力下对逃逸有免疫力。此外,它们的中和效力比最强效的SARS-CoV-2特异性中和抗体低几个数量级。中和被认为是抗冠状病毒S蛋白抗体的关键作用机制,并且先前已被证明与动物模型中的疗效相关,因此可能被证明是初始临床疗效的最重要驱动力。然而,正如在这些研究人员的单一抗体逃逸研究中所证实的那样,即使是高强效的中和也不能阻止病毒逃逸突变体的快速产生,逃逸仍然是单一抗体治疗方法的主要问题。
这项研究描述的数据有力地支持了这样一个概念,即抗体组合疗法可能提供一个强大的方法,以最大限度地减少SARS-CoV-2的突变逃逸;特别是,这些研究人员的研究指出了抗体组合治疗---选择两种结合独特的非重叠的病毒靶标区域(就这项研究而言,S蛋白的RBD),因而需要在两个不同的遗传位点同时发生不太可能发生的突变以便病毒逃逸---的潜在价值。临床候选广效性的选择标准,包括针对自然循环序列变异的功能评估,以及包含具有非重叠表位的多种抗体,可以提供增强的保护,防止疗效丧失。未来的体内动物和人类临床研究需要密切关注可能出现的逃逸突变体和潜在的后续药效损失。广泛强效的候选抗体的临床标准,包括针对自然循环序列变异的功能评估,以及包含多种结合表位不存在重叠的抗体,可能提供增强的保护,防止失效。未来的体内动物和人体临床研究需要密切关注可能出现的逃逸突变体以及随后可能发生的药物疗效丧失。(生物谷 Bioon.com)
参考资料:
Alina Baum et al. Antibody cocktail to SARS-CoV-2 spike protein prevents rapid mutational escape seen with individual antibodies. Science, 2020, doi:10.1126/science.abd0831.
科学家们最近利用基因人源化的小鼠和来自恢复期患者的B细胞,产生了一个非常大的靶向SARS-CoV-2 S蛋白的受体结合结构域(RBD)的高强效全人中和抗体的集合。产生这个非常大的集合的预期目标是筛选成对可以同时结合S蛋白的RBD的高强效抗体,因此它们可能构成治疗性的抗体混合物,不仅可以成为一种有效的治疗,而且也可能防止为了应对单一抗体治疗的选择性压力而产生的病毒逃逸突变体引起的抗体抵抗性。
在一项新的研究中,为了评估再生元制药公司(Regeneron Pharmaceuticals)近期描述的抗病毒抗体对截至2020年3月底已确定的可公开获得的SARS-CoV-2序列(代表超过7000个独特的基因组)所代表的一系列S蛋白RBD突变体的有效性,该公司的研究人员使用了表达这些SARS-CoV-2 S蛋白突变体的VSV假颗粒系统。他们的前八种中和抗体都可有效地抵抗所有测试的突变体(表1),从而展示了对在人类中传播的SARS-CoV-2的广泛覆盖。相关研究结果于2020年6月15日在线发表在Science期刊上,论文标题为“Antibody cocktail to SARS-CoV-2 spike protein prevents rapid mutational escape seen with individual antibodies”。

表1.抗SARS-CoV-2 S蛋白单克隆抗体
接下来,通过使用复制性的VSV-SARS-CoV-2-S病毒(图1A),在单一抗体和抗体组合的压力下选择逃逸突变体。在第一次传代时,针对4种抗体中的每一种,他们迅速确定了多种独立的逃逸突变体(图1,B和C,和图2)。在第二次传代时,这些突变体中的一些很容易在病毒群体中固定下来,对高达50ug/ml的抗体浓度产生抵抗力。对逃逸突变体的测序(图2)显示,单个氨基酸的变化可以破坏经筛选后广泛抵抗所有已知的RBD突变体的抗体的结合。

图1.逃逸突变体筛选流程。
接下来,这些研究人员评估了用他们之前描述的抗体组合(REGN10987+REGN10933)处理后的逃逸突变情况,这种抗体组合的合理设计是通过包含两种抗体来避免逃逸突变,这两种抗体结合RBD的不同的非重叠区域,因此可以同时结合和阻断RBD功能。在这种抗体组合的存在下培养VSV-SARS-CoV-2-S病毒,并没有导致逃逸突变体的产生(表2,图1,B和C,以及图2)。因此,这种选择的抗体组合并没有快速导致逃逸突变体产生,这大概是因为逃逸突变需要病毒在两个不同的遗传位点同时发生突变的可能性不大,从而破坏这种抗体组合中两种抗体的结合和中和。

图2.对传代病毒进行深度测序,确定逃逸突变。
除了上述抗体组合之外,他们还评估了用其他的抗体组合物(REGN10989+REGN10934和REGN10989+REGN10987)处理后的逃逸突变情况,这次由完全或部分竞争结合RBD的抗体组成---两种抗体结合到RBD上的区域存在重叠。在这些抗体组合处理的选择压力下,对一种组合有抵抗性的逃逸突变体迅速产生,但对另一种组合没有抵抗性(表2,图1,B和C,以及图2)。对于一种各组分表现出完全竞争的抗体组合(REGN10989+REGN10934),一个氨基酸替换就足以破坏这种抗体组合的中和作用,从而证实这两种抗体都需要与E484残基结合才能中和SARS-CoV-2。有趣的是,这种快速逃逸并没有发生在另一种不同的各组分只表现出部分竞争的抗体组合(REGN10989+REGN10987)中;当REGN10989事先结合时,REGN10987可以较弱地与RBD结合。因此,即使是不选择同时结合的抗体组合,也可能有时会阻止逃逸突变产生,这是因为它们的表位只有部分重叠,或者因为可导致逃逸的残基不容易被这种病毒耐受,因此不容易被选择。

表2.对单一抗S蛋白抗体和抗体组合对编码单个逃逸突变的假颗粒的中和效力。
为了从功能上证实通过测序检测到的这些S蛋白突变是SARS-CoV-2抗体中和能力丧失的原因,他们构建出表达单个确定的S蛋白突变的VSV-SARS-CoV-2刺突假颗粒。将这些假颗粒用于单一抗体处理和抗体组合处理的中和试验,并计算IC50值(表2)。正如预期的那样,携带在四种单一抗体以及REGN10989+REGN10934竞争性抗体组合的存在下进行病毒传代时选择的氨基酸突变的假颗粒,足以完全消除或大大降低这些处理在这些试验中的中和能力。在两种抗体处理后产生的病毒群体中,在早期传代时低频检测到的单逃突变体(如REGN10934和REGN10987处理后产生的突变K444Q),在其中一种抗体(REGN10987)存在下的后期传代时固定下来,从而能够破坏这两种抗体组合使用时的中和能力。这表明抗体可以驱动病毒在不同的方向进化和逃逸。然而,如果两种抗体具有部分重叠的结合表位,那么由一种抗体导致的逃逸突变体在病毒群体中固定下来,会导致另一种抗体的活性丧失,这凸显了广泛使用单一抗体治疗的风险。重要的是,REN10987+REGN10933抗体组合---由两种可以同时结合RBD上的两个独立表位的抗体组成---保留了中和所有已发现的RBD突变体的能力。
众所周知,RNA病毒会随着时间的推移而积累突变,任何抗病毒治疗的一个重要关注点是可能选择治疗诱导的逃逸突变体。一种防止逃避抗体治疗的常见策略涉及选择结合到保守表位的抗体,然而这种策略可能是不够的。虽然可以根据序列和结构分析对表位的保守性进行一些有依据的分析,但在强大的选择压力下,逃逸的可能性仍然存在。事实上,用抗流感病毒血凝素主干(hemagglutinin stem)结合抗体进行的逃逸研究表明,尽管不同流感亚型之间的血凝素主干表位高度保守,但仍可能出现逃逸突变体,一些逃逸突变产生在抗体表位区域的外面。在多种冠状病毒中表现出广泛中和能力因而可能靶向更多保守性残基的抗体尚未显示出在选择压力下对逃逸有免疫力。此外,它们的中和效力比最强效的SARS-CoV-2特异性中和抗体低几个数量级。中和被认为是抗冠状病毒S蛋白抗体的关键作用机制,并且先前已被证明与动物模型中的疗效相关,因此可能被证明是初始临床疗效的最重要驱动力。然而,正如在这些研究人员的单一抗体逃逸研究中所证实的那样,即使是高强效的中和也不能阻止病毒逃逸突变体的快速产生,逃逸仍然是单一抗体治疗方法的主要问题。
这项研究描述的数据有力地支持了这样一个概念,即抗体组合疗法可能提供一个强大的方法,以最大限度地减少SARS-CoV-2的突变逃逸;特别是,这些研究人员的研究指出了抗体组合治疗---选择两种结合独特的非重叠的病毒靶标区域(就这项研究而言,S蛋白的RBD),因而需要在两个不同的遗传位点同时发生不太可能发生的突变以便病毒逃逸---的潜在价值。临床候选广效性的选择标准,包括针对自然循环序列变异的功能评估,以及包含具有非重叠表位的多种抗体,可以提供增强的保护,防止疗效丧失。未来的体内动物和人类临床研究需要密切关注可能出现的逃逸突变体和潜在的后续药效损失。广泛强效的候选抗体的临床标准,包括针对自然循环序列变异的功能评估,以及包含多种结合表位不存在重叠的抗体,可能提供增强的保护,防止失效。未来的体内动物和人体临床研究需要密切关注可能出现的逃逸突变体以及随后可能发生的药物疗效丧失。(生物谷 Bioon.com)
参考资料:
Alina Baum et al. Antibody cocktail to SARS-CoV-2 spike protein prevents rapid mutational escape seen with individual antibodies. Science, 2020, doi:10.1126/science.abd0831.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


