Nature Genetics:揭示女性生育力的基因密码:CCDC201变异对绝经和生育的深远影响
来源:生物探索 2024-09-02 10:06
研究的结果表明,携带CCDC201基因p.(Arg162Ter)突变的女性可能需要更早进行生殖健康咨询和相关干预,以应对潜在的提前绝经及其带来的健康风险。
Nature Genetics的研究报道“Homozygosity for a stop-gain variant in CCDC201 causes primary ovarian insufficiency”,正是在这一背景下开展的。研究人员针对174,329名来自冰岛、丹麦、英国和挪威的绝经后女性,采用隐性模型(recessive model)进行了GWAS分析,旨在识别那些对AOM具有显著影响的低频遗传变异。在此过程中,研究人员发现了CCDC201基因中的一个截断突变(rs117316434),该变异以纯合子形式存在时,会导致女性提前9年进入绝经,并且在这些纯合子中,近一半会发展为POI。
CCDC201基因直到2022年才被确定为编码蛋白质的基因,该蛋白质在卵母细胞中高度表达。然而,这一突变导致的蛋白质功能丧失对于卵巢功能产生了显著影响,促使女性的生育窗口显著缩短。这项发现不仅为POI的遗传机制提供了新的见解,也凸显了在基因筛查中考虑不同遗传模型的重要性。
基于这项研究的结果,携带CCDC201基因截断突变的女性可能需要更早进行生殖健康咨询和相关干预,以应对潜在的提前绝经及其带来的健康风险。这一发现为生殖健康领域的个性化医疗和早期干预提供了重要的科学依据。
近年来,随着社会的发展,女性推迟生育的趋势越来越明显。然而,这一趋势与女性生理上的自然衰老过程存在矛盾,特别是与卵巢功能的下降密切相关。原发性卵巢功能不全(Primary Ovarian Insufficiency, POI)是影响女性生育能力的主要因素之一,约有1-4%的女性在40岁之前因卵巢功能丧失而进入绝经。尽管通过全基因组关联研究(Genome-Wide Association Studies, GWAS)已经鉴定出多个与绝经年龄(Age of Menopause, AOM)相关的基因变异,但大多数研究都集中在加性模型(Additive Model)下,而对隐性模型(Recessive Model)的探索相对较少。
在这项研究中,研究团队通过全基因组关联研究(Genome-Wide Association Studies, GWAS)对174,329名绝经后女性样本进行了详细的分析,旨在寻找与绝经年龄(Age of Menopause, AOM)显著相关的低频遗传变异。该研究的特别之处在于采用了隐性模型(Recessive Model),而非通常使用的加性模型(Additive Model),从而识别出那些可能因加性效应被忽略的关键变异。
样本数据来自四个国家,分别是冰岛(27,281人)、英国(137,906人)、丹麦(5,978人)和挪威(3,161人)。这些女性的基因组数据通过高覆盖度的全基因组测序(Whole-Genome Sequencing, WGS)获得,总共分析了3.93千万个序列变异。为了保证分析结果的准确性,研究团队首先排除了受外科手术(如子宫切除术或卵巢切除术)影响的样本,确保所有被纳入分析的女性均为自然绝经。接下来,通过质量控制和混合线性模型(Mixed Linear Model)校正可能的混杂因素,如种群结构和潜在的基因型偏倚。
在研究中,研究团队通过对这些绝经后女性样本进行GWAS分析,发现了一个与绝经年龄(Age of Menopause, AOM)显著相关的低频截断变异,即CCDC201基因中的p.(Arg162Ter)变异(rs117316434)。
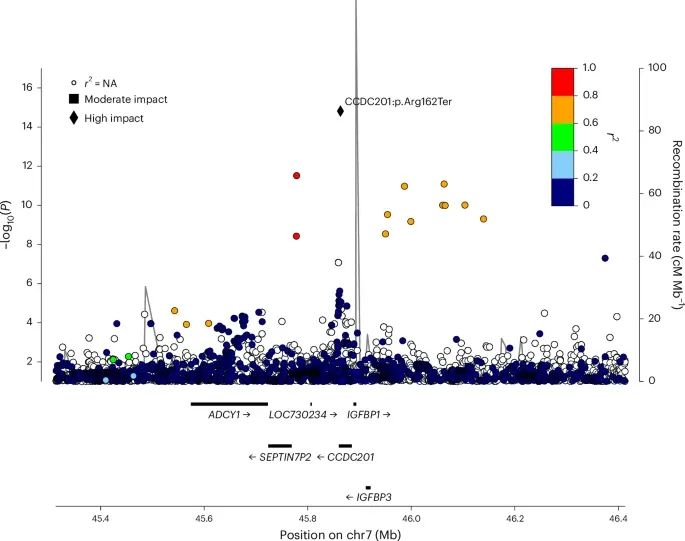
CCDC201基因位点(7q12.3)区域的关联图(Credit: Nature Genetics)
该图显示了该区域内所有变异与绝经年龄(Age of Menopause, AOM)之间的关联强度,每个点代表一个单核苷酸多态性(SNP),Y轴表示这些变异与AOM的关联显著性(以-log10(P)表示)。图中,p.(Arg162Ter)变异被标记为一个钻石形状,突出了该突变在该区域内与AOM显著相关。图中还可能展示了邻近基因及其与p.(Arg162Ter)变异的连锁不平衡(LD)情况,这有助于了解该突变在基因组中的具体位置及其与周围变异的关系。整体结果强调了p.(Arg162Ter)变异在该区域内作为主要影响因子的突出地位。
CCDC201基因变异对绝经年龄的影响
研究中发现,在携带p.(Arg162Ter)变异的女性中,该变异的纯合子(homozygotes)与杂合子(heterozygotes)及非携带者相比,绝经年龄平均提前了9年(P=1.3×10^-15)。冰岛样本中,6名携带纯合子变异的女性的平均绝经年龄为40岁,而非携带者的平均绝经年龄为48岁(差异8年)。英国样本中,16名携带纯合子变异的女性平均绝经年龄为40.8岁,而非携带者的平均绝经年龄为50.3岁(差异9.5年)。在丹麦和挪威样本中,尽管样本量较小,但也观察到类似的趋势,分别为10年和7.6年的提前。
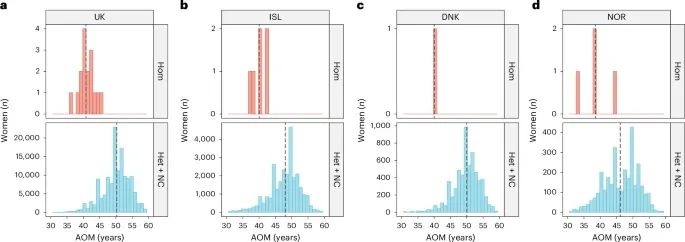
不同人群和基因型下的绝经年龄分布情况(Credit: Nature Genetics)
图中按基因型(即携带p.(Arg162Ter)变异的纯合子、杂合子和未携带者)分别展示了各组女性的绝经年龄分布,并将这些数据进一步细分为不同的人群(例如冰岛、英国、丹麦和挪威等)。结果显示,携带p.(Arg162Ter)变异的纯合子女性的绝经年龄明显早于杂合子和未携带者,且这一趋势在不同人群中一致。
生育能力的影响
除了绝经年龄的显著提前,p.(Arg162Ter)变异还对女性的生育能力产生了重要影响。数据显示,携带该变异的女性比未携带者平均少生一个孩子(P=0.00011)。特别是:在携带该变异的女性中,只有16%在30岁之后仍有生育,而在非携带者中,这一比例高达51%。17名携带该变异的纯合子女性的最后一次生育年龄比非携带者平均提前了5年(P=3.8×10^-5)。携带p.(Arg162Ter)变异的女性更可能没有孩子或只生一个孩子,进一步证实了该变异对生育能力的负面影响。

不同人群和基因型下的生育年龄和生育子女数量的分布情况(Credit: Nature Genetics)
图中根据基因型(即携带p.(Arg162Ter)变异的纯合子、杂合子和未携带者)分别展示了各组女性的生育年龄(即母亲生育时的年龄)和生育的子女数量。这些数据同样被细分为不同的人群(如冰岛、英国、丹麦和挪威等)进行分析。结果显示,携带p.(Arg162Ter)变异的女性通常在较早的年龄生育,而且她们的生育子女数量比未携带者明显减少。这一趋势在不同人群中均表现出一致性。
此外,图中还展示了不同基因型下的生育年龄和子女数量的重叠情况,进一步强调了p.(Arg162Ter)变异对女性生育能力的显著影响,以及这一影响在人群间的普遍性。这些结果表明,携带该变异的女性不仅绝经年龄提前,生育能力也显著下降。
不孕症的风险
研究还发现,携带p.(Arg162Ter)变异的女性患不孕症的风险显著增加。具体而言,这些女性被诊断为不孕症的几率是非携带者的7.3倍(P=0.00019)。
对其他生殖和身体特征的影响
研究团队还分析了p.(Arg162Ter)变异对34个其他生殖、人体测量和激素特征的影响。然而,除了对绝经年龄和生育能力的显著影响外,p.(Arg162Ter)变异未对性激素水平、体重指数(BMI)或男性生殖能力等其他指标表现出显著关联。这表明该变异的效应主要集中在女性的卵巢功能上。
CCDC201基因的表达特征
CCDC201基因编码的是一种富含螺旋结构域的蛋白质。根据研究数据,该基因在女性的生殖系统中,尤其是在卵母细胞(oocytes)中表现出较高的表达水平。这一发现基于对不同组织的RNA测序(RNA-seq)数据和蛋白质表达数据的分析,显示CCDC201基因在卵巢、乳腺和胎盘中的表达最为显著。此外,单细胞RNA测序数据也表明,该基因在卵母细胞中的表达高于其他组织。
在研究中,研究人员分析了不同年龄段女性卵巢组织中CCDC201基因的表达水平,发现该基因在20-49岁的女性卵巢中表达最为显著,而在50岁以上的女性中表达几乎消失。这表明,CCDC201基因的表达与女性的生殖年龄密切相关。
CCDC201基因突变的分子机制
p.(Arg162Ter)变异是一个截断突变,位于CCDC201基因的第三个也是最后一个外显子中。这一突变导致CCDC201蛋白的C端缺失了25个氨基酸。虽然这一段缺失的具体功能尚未完全明确,但研究人员推测,这一突变可能通过以下几种机制影响卵母细胞的发育和卵巢功能:
蛋白质功能丧失:由于p.(Arg162Ter)突变位于CCDC201基因的最后一个外显子,这一截断突变可能导致蛋白质在翻译后的稳定性降低,或直接导致蛋白质无法正常折叠和功能化。研究中指出,这25个丢失的氨基酸在哺乳动物中高度保守,提示它们在蛋白质的结构和功能中起到关键作用。
卵母细胞的早期耗竭:CCDC201蛋白在卵母细胞中的高表达及其与卵母细胞发育相关的推测功能表明,p.(Arg162Ter)变异可能导致卵母细胞的加速耗竭。卵母细胞数量的减少会直接影响卵巢储备,导致女性在较早的年龄进入绝经(AOM提前)。
与其他生殖调控基因的相互作用:研究中还提到,CCDC201基因是卵母细胞特异性转录因子FIGLA的下游靶基因。FIGLA已知在早期卵泡发生中发挥作用,而CCDC201作为其下游靶基因,可能在调控卵母细胞存活和发育方面起到重要作用。因而,p.(Arg162Ter)突变可能通过干扰这些关键发育过程,进一步加速卵母细胞的消耗。
基因突变的频率与人群分布
在不同的北欧人群中,p.(Arg162Ter)突变的次等位基因频率(MAF)约为0.74%到1.15%。该变异在北欧的分布呈现出由北向南逐渐减少的趋势。例如,在斯堪的纳维亚人群中,这一变异的频率最高(AF=1.25%),相当于每6,400人中有1人是纯合子,而在东南欧人群中,这一频率最低(AF=0.11%),即每826,000人中才有1人是纯合子。
研究还指出,这一变异在亚洲和非洲裔人群中的频率非常低,几乎可以忽略不计。这种显著的地理和种族差异表明,p.(Arg162Ter)突变可能是特定人群中的遗传“瓶颈”或特定区域内基因漂变的结果。
功能研究与未来方向
目前,关于CCDC201基因和p.(Arg162Ter)变异的功能研究仍处于初步阶段。虽然研究表明这一变异对女性生殖健康有重大影响,但其确切的分子机制还需要通过进一步的实验研究来揭示。未来可能的研究方向包括:
蛋白质结构功能分析:利用生物信息学工具和实验方法,解析p.(Arg162Ter)突变导致的蛋白质结构变化,探索其对蛋白质功能的影响。
动物模型研究:由于CCDC201基因在哺乳动物中高度保守,可以通过建立动物模型(如小鼠模型)进一步研究这一基因在卵母细胞发育中的作用,以及p.(Arg162Ter)突变的具体影响。
临床研究和应用:将这一发现应用于临床实践,特别是在早期筛查和生殖健康管理中,开发基于CCDC201基因的诊断和治疗方案。
该研究的结果表明,携带CCDC201基因p.(Arg162Ter)突变的女性可能需要更早进行生殖健康咨询和相关干预,以应对潜在的提前绝经及其带来的健康风险。该突变的识别为早期诊断和预防措施的制定提供了重要依据。例如,可以建议携带该突变的女性考虑早期冻卵或其他生育保留措施,以减少生育能力下降带来的负面影响。此外,这一发现也为生殖健康领域的个性化医疗和基因筛查提供了新的思路,帮助识别高风险个体,从而制定更为有效的管理方案。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


