Nat Commun | 浙江大学冯新华团队发现SNX8可实现溶酶体重组并逆转溶酶体贮积障碍
来源:生物探索 2024-03-27 08:24
分选连接蛋白(SNX)是一类膜结合蛋白,具有磷酸肌醇结合PX结构域。SNX家族的 12个成员携带BAR域能够诱导膜曲率,因此被赋予了肾小管形成能力。
浙江大学冯新华团队在Nature Communications 发表题为“SNX8 enables lysosome reformation and reverses lysosomal storage disorder”的研究论文,该研究报道了分选连接蛋白SNX8促进溶酶体管化,这是溶酶体重组所需的过程,并且SNX8的缺失导致人类细胞中LSD的表型特征。
SNX8过表达挽救了细胞中LSD的特征,而基于AAV的SNX8向大脑的递送挽救了小鼠的LSD表型。重要的是,通过筛选天然化合物库,研究鉴定了三种小分子,它们增强了SNX8-溶酶体结合并逆转了人类细胞和小鼠中的LSD表型。总之,该研究为LSD的治疗提供了潜在的解决方案。

溶酶体贮积症(LSD)是由编码水解酶、转运蛋白、离子通道和运输蛋白的溶酶体相关基因突变引起的毁灭性代谢疾病。目前已鉴定出60多种不同类型的LSD,LSD的特点是将物质储存在溶酶体中,导致LSD之间共有的继发性溶酶体相关功能障碍。然而,它们基本上共享其他溶酶体表型,例如溶酶体增大、消化减少、膜运输/定位缺陷和溶酶体重组受损LSD的严重程度取决于致病突变的性质,但即使是轻度LSD亚型也可能导致青少年死亡,而严重亚型可导致婴儿期发病和儿童期死亡。
作为遗传性疾病,LSD不能完全治愈,除非病因基因得到纠正,这在临床上尚不可用。目前,酶替代疗法(ERT)、基因疗法和底物减少疗法仍然是少数已建立或正在临床试验中的方法,但每种方法都有严重的局限性或缺点。上述所有疗法的一个共同缺点是它们对LSD的特定亚型具有特异性。 由于每种类型的LSD的发生率都非常低,因此需要对大多数LSD进行广谱治疗。
最近的研究表明,考虑到大多数LSD表型是由继发性溶酶体功能障碍而不是原发性基因缺陷引起的,在全球范围内增强溶酶体功能可能是广谱LSD治疗的一种有前途的方法。溶酶体功能上调存在两种重要途径。一种是通过TFEB激活溶酶体基因的转录,另一种是在功能性溶酶体数量减少的情况下激活溶酶体重组。TFEB激活是增强溶酶体功能的有效方法。一些报告表明,通过过表达TFEB 或分子TFEB 激活剂来激活 TFEB 介导的转录可减少 LSD 或神经退行性疾病(ND)表型。然而,由于 TFEB 激活导致大多数溶酶体基因的表达上调,其作用是非特异性的,并可能导致细胞应激。
另一方面,溶酶体重整是在消耗的溶酶体上发生的按需过程。因此,靶向溶酶体重整可能是LSD治疗的更具体的策略。由于LSD细胞通常表现出溶酶体功能降低和溶酶体重组受损,促进溶酶体重整应恢复功能性溶酶体并减少细胞损伤。在过去十年中,溶酶体重整途径的许多成分被鉴定出来,包括mTOR和PIP5K1B作为启动,驱动蛋白-1,动力蛋白和dynactin作为驱动力,网格蛋白和PIP5K1A等作为膜出芽和原溶酶体的生成。由于管状结构是溶酶体重整的平台,因此小管的形成对整个重整过程至关重要。然而,负责肾小管形成和维持的因素仍未确定。
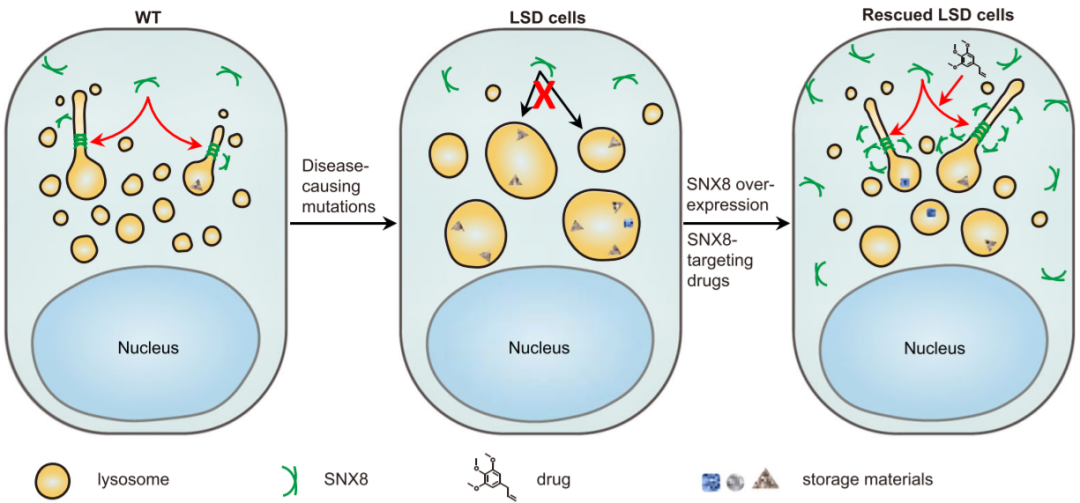
模式图(Credit: Nature Communications)
分选连接蛋白(SNX)是一类膜结合蛋白,具有磷酸肌醇结合PX结构域。SNX家族的 12个成员携带BAR域能够诱导膜曲率,因此被赋予了肾小管形成能力。事实上,发现多种 SNX-BAR 蛋白介导内体小管形成并参与内体逆行运输。该研究报告了溶酶体小管的形成需要SNX8的功能,并且在较小程度上需要SNX2的功能,SNX8是SNX-BAR家族的两个成员。在LSD模型细胞系和小鼠模型中,SNX8或SNX2/SNX8缺失均可诱导LSD表型,而SNX8过表达可挽救LSD表型。此外,还发现了一些可以通过上调SNX8来降低LSD表型的小分子。综上所述,研究结果可能会为LSD患者带来潜在的广谱疗法。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


