胰腺癌重磅级研究盘点(第3期)
来源:本站原创 2019-04-30 22:46
2019年4月30日讯/生物谷BIOON/---如今,胰腺癌现已经成为全球第七大致死性癌症,患者五年的存活率不到5%。尽管临床医学的发展使很多癌症已经成为了一种可控甚至治愈的疾病,但非常遗憾的是,胰腺癌恰恰是科学家尚未攻克的癌症之一,该病从预防、诊断、治疗到预后效果并不不理想,随着人群生活水平的提高及饮食结构的改变,近年来胰腺癌的发病率呈现上升且年轻化的趋势。基于此,小编胰腺癌研究进展进行一番梳理
2019年4月30日讯/生物谷BIOON/---如今,胰腺癌现已经成为全球第七大致死性癌症,患者五年的存活率不到5%。尽管临床医学的发展使很多癌症已经成为了一种可控甚至治愈的疾病,但非常遗憾的是,胰腺癌恰恰是科学家尚未攻克的癌症之一,该病从预防、诊断、治疗到预后效果并不不理想,随着人群生活水平的提高及饮食结构的改变,近年来胰腺癌的发病率呈现上升且年轻化的趋势。
基于此,小编胰腺癌研究进展进行一番梳理,以飨读者。
1.Cell:通过构建胰腺癌干细胞分子依赖性图谱,揭示胰腺癌治疗新策略
doi:10.1016/j.cell.2019.03.010
在一项新的研究中,来自美国加州大学圣地亚哥分校等研究机构的研究人员通过使用RNA测序(RNA-seq)、染色质免疫沉淀测序(ChIP-seq)和全基因组CRISPR分析来绘制胰腺癌干细胞的分子依赖性图谱,其中胰腺癌干细胞是优先驱动肿瘤发生和进展的高度治疗抵抗性 细胞。相关研究结果发表在2019年4月18日的Cell期刊上,论文标题为“A Multiscale Map of the Stem Cell State in Pancreatic Adenocparcinoma”。
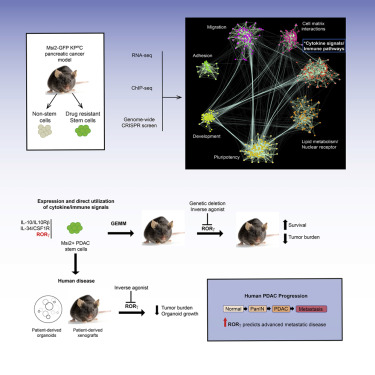
这种整合的基因组方法揭示了胰腺癌上皮细胞对免疫调节信号的意外利用。特别是,已知能促进炎症和T细胞分化的细胞核激素受体RORγ(retinoic-acid-receptor-related orphan receptor gamma, 视黄酸受体相关孤儿受体γ)在胰腺癌进展过程中被上调,而且针对 它的遗传抑制和药物抑制都会导致胰腺癌生长出现严重缺陷和生存率的显著提高。此外,对患者进行的大规模回顾性分析显示,RORγ表达可能预测胰腺癌的侵袭性,这是因为它与晚期疾病和癌症转移呈正相关。
2.Nature:靶向胰腺癌致命弱点取得令人鼓舞的结果
doi:10.1038/s41586-019-1130-6
胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)的预后很差,这很大程度上是由于诊断效率低和耐药性强。胰腺星状细胞(ancreatic stellate cell, PSC)的活化和随后的致密基质产生是导致这种侵袭性生物学的显著特征。 胰腺星状细胞与胰腺癌细胞(pancreatic cancer cell, PCC)之间的相互作用不仅促进肿瘤进展和转移,而且还维持它们自身的活化,这就形成一种恶性循环,从而加剧肿瘤发生和耐药性出现。此外,在PDAC肿瘤发生期间,胰腺星状细胞活化较早地发生,而且活化的胰腺星状细胞占肿瘤体积的很大一部分,从而提供了丰富的易于检测的因子。
在一项新的研究中,来自美国沙克生物研究所、中国南方科技大学、加拿大多伦多大学等多家研究机构的研究人员猜测胰腺星状细胞与胰腺癌细胞之间的通信可能是一种可利用的靶标,用于开发治疗和诊断PDAC的有效策略。从对分泌性疾病调节物和内在分子机制的系统蛋白质组学研究开始,他们揭示出白血病抑制因子(leukaemia inhibitory factor, LIF)是活化的PSC作用于胰腺癌细胞的关键旁分泌因子。相关研究结果于2019年4月17日在线发表在Nature期刊上,论文标题为“Targeting LIF-mediated paracrine interaction for pancreatic cancer therapy and monitoring”。
对LIF进行药物阻断和对Lifr进行基因剔除都会显著增加化疗的疗效,从而延长PDAC小鼠模型的存活,这主要是通过调节胰腺癌细胞分化和上皮-间质转化(EMT)状态实现的。再者,在小鼠模型和人PDAC中,胰腺中LIF的异常产生仅限于病理状况并且与PDAC发病机理相关,而且循环LIF水平的变化与肿瘤对治疗的反应存在良好的关联性。
3.Mol Cell:两种特殊酶类的平衡或与胰腺癌患者的生存直接相关
doi:10.1016/j.molcel.2019.02.018
蛋白激酶C(PKC)对于一系列细胞活动至关重要,包括细胞生存、增殖和迁移等,这些细胞活动都必须被严格控制以免细胞失控形成肿瘤;近日,来自加州大学圣地亚哥医学院等机构的科学家们通过研究发现,另一种名为PHLPP1的酶类或许能扮演“校对者”的角色密切关注PKC的行为,相关研究结果刊登于国际杂志Molecular Cell上。
在胰腺癌中研究者发现,高水平的PHLPP1会导致PKC水平下降,而这往往与患者存活率低直接相关。研究者表示,未来临床医生有望利用胰腺癌患者机体中PHLPP1/PKC的水平来作为评估患者预后的预测工具,同时还能帮助开发新型治疗性药物,通过抑制PHLPP1并增强PKC的水平来治疗相应疾病。
研究人员深入研究阐明了细胞调节PKC活性的分子机制,他们发现,任何时候只要细胞中无意中会产生过度活跃的PKC,作为校对员,PHLPP1就会对其进行标记并毁灭。Newton说道,这就意味着,细胞中PHLPP1的水平能确定PKC的量,这些酶类的水平对于研究胰腺癌至关重要。研究人员通过联合研究分析了来自肿瘤蛋白数据库的数据,包括与每一种肿瘤相关的患者信息等,在数据库中包含的105个胰腺肿瘤中,研究者发现,PHLPP1水平较高的肿瘤中PKC水平往往较低。
研究者还发现,高水平PHLPP1/低水平PKC的比率往往与胰腺癌患者预后不良有关,数据库中并没有一例PKC水平较低的胰腺癌患者存活超过5年半,换句话说,50%的低水平PHLPP1/高水平PKC的患者存活时间更久。目前研究尚处于早期阶段,研究者希望后期能够深入研究为开发新型胰腺癌诊断和治疗策略提供新的思路。研究者表示,如果我们能对胰腺癌患者进行检测并知晓其机体中高水平的PHLPP1和低水平的PKC,这样我们就知道这类患者的预后并不好,或许我们就能通过抑制PHLPP1,并恢复PKC的水平来改善患者的生存几率。
4.Nature:重磅!科学家鉴别出胰腺癌的新型治疗靶点
doi:10.1038/s41586-019-1062-1
癌细胞往往需要大量的“食物”来生存并生长,近日,一项刊登在国际杂志Nature上的研究报告中,来自德克萨斯大学MD Anderson癌症中心的科学家们发现了一种能饿死胰腺癌细胞的新方法;文章中研究者利用了一种先进的方法来追踪胰腺癌细胞如何重排细胞表面的蛋白质,名为多配体蛋白聚糖-1(SDC1)的蛋白质能移动到细胞表面来对突变的KRAS信号产生反应,KRAS蛋白存在于超过90%的胰腺导管腺癌中。

研究者指出,细胞表面SDC1的定位对于胰腺癌细胞上调巨胞饮(macropinocytosis)过程非常重要,巨胞饮是细胞用来从周围环境中净化资源从而转化为能量或促进细胞分裂的一种机制,尽管胰腺癌细胞中突变的KRAS能够激活巨胞饮过程,但控制该过程的分子机制目前研究人员并不清楚,研究者发现,SDC1能对来自KRAS的信号产生反应并在细胞表面积累从而诱导上述途径。
研究者Draetta说道,截至目前为止,科学家还无法实现对巨胞饮过程进行药理学的抑制,但本文研究中我们发现了SDC1调节KRAS驱动的巨胞饮过程的关键角色,这对于深入理解SDC1的靶点作用并开发新型胰腺癌疗法提供了新的线索。
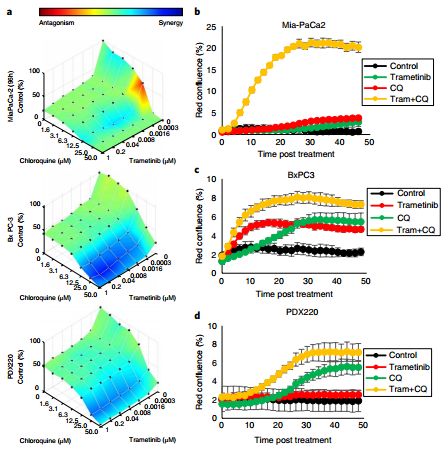
5.PNAS:研究发现胰腺癌的克星——联合自噬和DNA修复抑制剂有望杀死胰腺癌!
doi:10.1073/pnas.1812410116
加州大学洛杉矶分校(University of California at Los Angeles,UCLA)Jonsson综合癌症中心的研究人员已经找到了一种同时使用两种药物治疗世界上最致命的癌症——胰腺癌的新策略。这种联合疗法使用一种药物抑制溶酶体(可以使癌细胞循环利用胞内必需的营养物质以继续生存)的活性,另一种药物抑制肿瘤细胞修复DNA的信号通路。他们在实验室培养的胰腺癌细胞系和小鼠肿瘤模型上进行的实验表明这种联合疗法疗效显著。
研究人员对两组数据进行了分析,试图找出依赖于溶酶体的信号通路的相关机制,研究人员首先将氯喹(一种疟疾特效药)和500多种不同的抑制剂联合作用于胰腺癌细胞,以筛选可能产生协同效应的药物组合。通过这个筛查的信息,研究人员找到了一类叫做复制应激反应抑制剂的抑制剂。在第二组数据中,研究人员测试了只接受氯喹处理的胰腺癌细胞的代谢产物。他们发现氯喹会引起天冬氨酸减少,这是一种细胞合成核苷酸用于DNA修复和复制的重要氨基酸。
这项研究表明联合氯喹和复制应激反应抑制剂可能是一种延缓胰腺癌病人肿瘤生长并改善病人预后的有效联合疗法。这项发现还强调了老药新用——利用现有药物治疗其他疾病的重要性。相关研究成果于近日发表在《PNAS》上。
6.Cell Metab:胰腺癌为什么耐药?可能是巨噬细胞在捣鬼!
doi:10.1016/j.cmet.2019.02.001
一项由密歇根大学(University of Michigan,UM)Rogel癌症中心的研究人员领导完成的最新研究发现肿瘤相关的免疫细胞分泌的相似的化合物可以削弱一种治疗胰腺癌的一线化疗药物的疗效。
化疗药物吉西他滨是一种抗代谢药,它和细胞摄取的正常代谢物质很相似,但是一旦被细胞摄取,它就会通过扰乱细胞的功能来杀死细胞。胰腺癌中的肿瘤相关免疫细胞会释放相似的代谢物质,这些物质会抑制吉西他滨杀伤癌细胞的能力。
这些结果将帮助预测哪些病人可能对吉西他滨治疗产生反应,也为揭示其他种类的肿瘤中免疫细胞在化疗耐药中扮演的角色提供了参考,相关研究成果于近日发表在《Cell Metabolism》上。
7.Nat Med重磅!新联合疗法显著抑制胰腺癌生长!
doi:10.1038/s41591-019-0367-9
在所有的癌症中,胰腺癌是最凶险的癌症,这种癌症患者的一年生存率极低,其治疗进展也落后于许多其他癌症。在一项近日发表在《Nature Medicine》上的最新研究中,来自美国犹他大学(UU)亨斯迈癌症研究所(HCI)的研究人员发现了一种治疗胰腺癌患者的新策略。
过去的研究已经发现只通过KRAS的角色或者影响自噬来治疗胰腺癌是无效的。在这项HCI新研究中,研究人员利用两种药物同时靶向了KRAS信号和自噬过程,结果在小鼠模型和病人身上都观察到了显著的疗效。HCI的医学科学家、UU内科医学教授Conan Kinsey博士和HCI癌症研究人员、UU皮肤医学教授Martin McMahon博士一起领导了这项研究。
研究人员发现一种联合疗法可以更有效治疗这种癌症。HCI的研究人员第一次在实验室动物模型和第一个临床病人身上观察到了这种疗法的抗癌效果。这项研究目前已经在HCI进行临床试验,不久将对美国全国开放。这项临床试验叫做THREAD,国家临床试验批号为03825289。该联合疗法同时使用两种美国FDA批准的药物治疗其他疾病,包括癌症,这项新的联合药物以口服药片的形式服用。
8.Oncotarget:超级增强子——治疗胰腺导管腺癌的新靶点!
doi:10.18632/oncotarget.26704
研究人员近日在包括c-MYC、MED1、OCT-4、NANOG和SOX2等基因的增强子区域发现了微小的H3K27AC标记,可以作为非癌的、癌性的以及转移性胰腺导管腺癌(Pancreatic ductal adenocarcinoma,PDAC)细胞系中的基因簇的一种超级增强子(super-enhancers,SE)。 在这项最新研究中,研究人员揭示了PDAC小鼠模型的进展过程中转录和增强子的改变是如何发生的。因此癌症研究迫切需要找到可以靶向和疾病进展相关的增强子的新型治疗药物。
主转录因子OCT4、SOX2和NANOG在鼠源胚胎干细胞基因组中的共定位是增强子活性的预测因子。由于细胞信号通路中现存的缺陷允许癌细胞改变它们增殖、转录 、生长、迁移、分化和死亡的方式,因此发现癌细胞增殖和生存依赖于SE驱动的转录为靶向癌细胞提供了一个新的治疗靶点。
9.Nature:几十年秘密终破解!揭示胰腺癌的两种独特的产生和生长方式
doi:10.1038/s41586-019-0891-2
在一项新的研究中,为了研究胰腺癌的起源,英国弗朗西斯克里克研究所的Hendrik Messal博士及其团队开发出一种新型方法,从而在三维水平下分析癌症活组织样本。这种技术揭示出胰腺癌是在胰腺导管壁中产生的,而且依赖于胰腺导管的尺寸,向内或向外生长。这就解释了几十年来人们在胰腺癌的二维切片中观察到的神秘形状差异。相关研究结果发表在2019年2月7日的Nature期刊上,论文标题为“Tissue curvature and apicobasal mechanical tension imbalance instruct cancer morphogenesis”。
通过在三维水平下分析胰腺癌的产生过程,这些研究人员确定了两种不同类型的起源自导管细胞的胰腺癌形成:在胰腺导管内部生长的“内生性(endophytic)”肿瘤和向胰腺导管外部生长的“外生性(exophytic)”肿瘤。为了找出癌细胞以特定方式生长的原因,他们分析了详细的三维图像,并且与构建了复杂计算机模型的生物物理学家合作。
论文共同作者Silvanus Alt 博士说,“我们对胰腺导管进行了模拟,描述了单个细胞的几何形状以便了解组织形状。这种模型和实验结果均证实当胰腺导管直径小于约20微米(大约为五十分之一毫米)时,癌症会向外生长。”
10.PNAS:为何胰腺癌对现有的免疫检查点抑制剂不感冒?关键在于VISTA过度表达!
doi:10.1073/pnas.1811067116
免疫检查点阻断药物(也称为免疫检查点抑制剂)通过阻断T细胞表面上的免疫检查点PD-1和CTLA-4来对癌症发起免疫攻击,可有效地治疗很多癌症。但是,到目前为止,作为最致命的癌症之一,胰腺癌对免疫检查点阻断药物治疗的抵抗性是出了名的。胰腺癌患者的五年存活率为7%或更低。
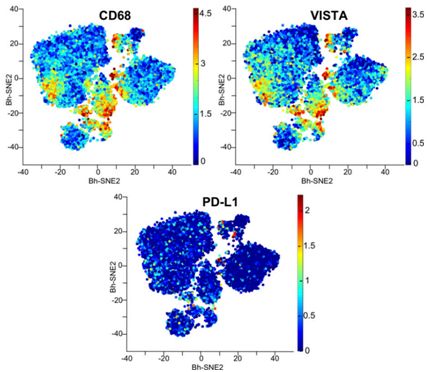
在一项新的研究中,来自美国德克萨斯大学MD安德森癌症中心的研究人员鉴定出一个潜在新的免疫治疗靶标。他们发现免疫检查点VISTA在浸润到胰腺瘤中的免疫细胞(特别是巨噬细胞)中过量表达。相关研究结果于2019年1月10日在线发表在PNAS期刊上,论文标题为“Comparison of immune infiltrates in melanoma and pancreatic cancer highlights VISTA as a potential target in pancreatic cancer”。论文通讯作者为德克萨斯大学MD安德森癌症中心泌尿外科肿瘤学与免疫学教授Padmanee Sharma博士和德克萨斯大学MD安德森癌症中心免疫学系主任Jim Allison博士。
Sharma说,“VISTA是胰腺癌的一个潜在治疗靶标,有几种阻断VISTA的抗体正在临床开发之中。还需要开展进一步的研究来看看我们是否能够为这些VISTA阳性细胞找到其他的治疗靶标。”(生物谷 Bioon.com)
基于此,小编胰腺癌研究进展进行一番梳理,以飨读者。
1.Cell:通过构建胰腺癌干细胞分子依赖性图谱,揭示胰腺癌治疗新策略
doi:10.1016/j.cell.2019.03.010
在一项新的研究中,来自美国加州大学圣地亚哥分校等研究机构的研究人员通过使用RNA测序(RNA-seq)、染色质免疫沉淀测序(ChIP-seq)和全基因组CRISPR分析来绘制胰腺癌干细胞的分子依赖性图谱,其中胰腺癌干细胞是优先驱动肿瘤发生和进展的高度治疗抵抗性 细胞。相关研究结果发表在2019年4月18日的Cell期刊上,论文标题为“A Multiscale Map of the Stem Cell State in Pancreatic Adenocparcinoma”。

图片来自Cell, 2019, doi:10.1016/j.cell.2019.03.010。
这种整合的基因组方法揭示了胰腺癌上皮细胞对免疫调节信号的意外利用。特别是,已知能促进炎症和T细胞分化的细胞核激素受体RORγ(retinoic-acid-receptor-related orphan receptor gamma, 视黄酸受体相关孤儿受体γ)在胰腺癌进展过程中被上调,而且针对 它的遗传抑制和药物抑制都会导致胰腺癌生长出现严重缺陷和生存率的显著提高。此外,对患者进行的大规模回顾性分析显示,RORγ表达可能预测胰腺癌的侵袭性,这是因为它与晚期疾病和癌症转移呈正相关。
2.Nature:靶向胰腺癌致命弱点取得令人鼓舞的结果
doi:10.1038/s41586-019-1130-6
胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)的预后很差,这很大程度上是由于诊断效率低和耐药性强。胰腺星状细胞(ancreatic stellate cell, PSC)的活化和随后的致密基质产生是导致这种侵袭性生物学的显著特征。 胰腺星状细胞与胰腺癌细胞(pancreatic cancer cell, PCC)之间的相互作用不仅促进肿瘤进展和转移,而且还维持它们自身的活化,这就形成一种恶性循环,从而加剧肿瘤发生和耐药性出现。此外,在PDAC肿瘤发生期间,胰腺星状细胞活化较早地发生,而且活化的胰腺星状细胞占肿瘤体积的很大一部分,从而提供了丰富的易于检测的因子。
在一项新的研究中,来自美国沙克生物研究所、中国南方科技大学、加拿大多伦多大学等多家研究机构的研究人员猜测胰腺星状细胞与胰腺癌细胞之间的通信可能是一种可利用的靶标,用于开发治疗和诊断PDAC的有效策略。从对分泌性疾病调节物和内在分子机制的系统蛋白质组学研究开始,他们揭示出白血病抑制因子(leukaemia inhibitory factor, LIF)是活化的PSC作用于胰腺癌细胞的关键旁分泌因子。相关研究结果于2019年4月17日在线发表在Nature期刊上,论文标题为“Targeting LIF-mediated paracrine interaction for pancreatic cancer therapy and monitoring”。
对LIF进行药物阻断和对Lifr进行基因剔除都会显著增加化疗的疗效,从而延长PDAC小鼠模型的存活,这主要是通过调节胰腺癌细胞分化和上皮-间质转化(EMT)状态实现的。再者,在小鼠模型和人PDAC中,胰腺中LIF的异常产生仅限于病理状况并且与PDAC发病机理相关,而且循环LIF水平的变化与肿瘤对治疗的反应存在良好的关联性。
3.Mol Cell:两种特殊酶类的平衡或与胰腺癌患者的生存直接相关
doi:10.1016/j.molcel.2019.02.018
蛋白激酶C(PKC)对于一系列细胞活动至关重要,包括细胞生存、增殖和迁移等,这些细胞活动都必须被严格控制以免细胞失控形成肿瘤;近日,来自加州大学圣地亚哥医学院等机构的科学家们通过研究发现,另一种名为PHLPP1的酶类或许能扮演“校对者”的角色密切关注PKC的行为,相关研究结果刊登于国际杂志Molecular Cell上。
在胰腺癌中研究者发现,高水平的PHLPP1会导致PKC水平下降,而这往往与患者存活率低直接相关。研究者表示,未来临床医生有望利用胰腺癌患者机体中PHLPP1/PKC的水平来作为评估患者预后的预测工具,同时还能帮助开发新型治疗性药物,通过抑制PHLPP1并增强PKC的水平来治疗相应疾病。
研究人员深入研究阐明了细胞调节PKC活性的分子机制,他们发现,任何时候只要细胞中无意中会产生过度活跃的PKC,作为校对员,PHLPP1就会对其进行标记并毁灭。Newton说道,这就意味着,细胞中PHLPP1的水平能确定PKC的量,这些酶类的水平对于研究胰腺癌至关重要。研究人员通过联合研究分析了来自肿瘤蛋白数据库的数据,包括与每一种肿瘤相关的患者信息等,在数据库中包含的105个胰腺肿瘤中,研究者发现,PHLPP1水平较高的肿瘤中PKC水平往往较低。
研究者还发现,高水平PHLPP1/低水平PKC的比率往往与胰腺癌患者预后不良有关,数据库中并没有一例PKC水平较低的胰腺癌患者存活超过5年半,换句话说,50%的低水平PHLPP1/高水平PKC的患者存活时间更久。目前研究尚处于早期阶段,研究者希望后期能够深入研究为开发新型胰腺癌诊断和治疗策略提供新的思路。研究者表示,如果我们能对胰腺癌患者进行检测并知晓其机体中高水平的PHLPP1和低水平的PKC,这样我们就知道这类患者的预后并不好,或许我们就能通过抑制PHLPP1,并恢复PKC的水平来改善患者的生存几率。
4.Nature:重磅!科学家鉴别出胰腺癌的新型治疗靶点
doi:10.1038/s41586-019-1062-1
癌细胞往往需要大量的“食物”来生存并生长,近日,一项刊登在国际杂志Nature上的研究报告中,来自德克萨斯大学MD Anderson癌症中心的科学家们发现了一种能饿死胰腺癌细胞的新方法;文章中研究者利用了一种先进的方法来追踪胰腺癌细胞如何重排细胞表面的蛋白质,名为多配体蛋白聚糖-1(SDC1)的蛋白质能移动到细胞表面来对突变的KRAS信号产生反应,KRAS蛋白存在于超过90%的胰腺导管腺癌中。

图片来源:public domain
研究者指出,细胞表面SDC1的定位对于胰腺癌细胞上调巨胞饮(macropinocytosis)过程非常重要,巨胞饮是细胞用来从周围环境中净化资源从而转化为能量或促进细胞分裂的一种机制,尽管胰腺癌细胞中突变的KRAS能够激活巨胞饮过程,但控制该过程的分子机制目前研究人员并不清楚,研究者发现,SDC1能对来自KRAS的信号产生反应并在细胞表面积累从而诱导上述途径。
研究者Draetta说道,截至目前为止,科学家还无法实现对巨胞饮过程进行药理学的抑制,但本文研究中我们发现了SDC1调节KRAS驱动的巨胞饮过程的关键角色,这对于深入理解SDC1的靶点作用并开发新型胰腺癌疗法提供了新的线索。
5.PNAS:研究发现胰腺癌的克星——联合自噬和DNA修复抑制剂有望杀死胰腺癌!
doi:10.1073/pnas.1812410116
加州大学洛杉矶分校(University of California at Los Angeles,UCLA)Jonsson综合癌症中心的研究人员已经找到了一种同时使用两种药物治疗世界上最致命的癌症——胰腺癌的新策略。这种联合疗法使用一种药物抑制溶酶体(可以使癌细胞循环利用胞内必需的营养物质以继续生存)的活性,另一种药物抑制肿瘤细胞修复DNA的信号通路。他们在实验室培养的胰腺癌细胞系和小鼠肿瘤模型上进行的实验表明这种联合疗法疗效显著。
研究人员对两组数据进行了分析,试图找出依赖于溶酶体的信号通路的相关机制,研究人员首先将氯喹(一种疟疾特效药)和500多种不同的抑制剂联合作用于胰腺癌细胞,以筛选可能产生协同效应的药物组合。通过这个筛查的信息,研究人员找到了一类叫做复制应激反应抑制剂的抑制剂。在第二组数据中,研究人员测试了只接受氯喹处理的胰腺癌细胞的代谢产物。他们发现氯喹会引起天冬氨酸减少,这是一种细胞合成核苷酸用于DNA修复和复制的重要氨基酸。
这项研究表明联合氯喹和复制应激反应抑制剂可能是一种延缓胰腺癌病人肿瘤生长并改善病人预后的有效联合疗法。这项发现还强调了老药新用——利用现有药物治疗其他疾病的重要性。相关研究成果于近日发表在《PNAS》上。
6.Cell Metab:胰腺癌为什么耐药?可能是巨噬细胞在捣鬼!
doi:10.1016/j.cmet.2019.02.001
一项由密歇根大学(University of Michigan,UM)Rogel癌症中心的研究人员领导完成的最新研究发现肿瘤相关的免疫细胞分泌的相似的化合物可以削弱一种治疗胰腺癌的一线化疗药物的疗效。
化疗药物吉西他滨是一种抗代谢药,它和细胞摄取的正常代谢物质很相似,但是一旦被细胞摄取,它就会通过扰乱细胞的功能来杀死细胞。胰腺癌中的肿瘤相关免疫细胞会释放相似的代谢物质,这些物质会抑制吉西他滨杀伤癌细胞的能力。
这些结果将帮助预测哪些病人可能对吉西他滨治疗产生反应,也为揭示其他种类的肿瘤中免疫细胞在化疗耐药中扮演的角色提供了参考,相关研究成果于近日发表在《Cell Metabolism》上。
7.Nat Med重磅!新联合疗法显著抑制胰腺癌生长!
doi:10.1038/s41591-019-0367-9
在所有的癌症中,胰腺癌是最凶险的癌症,这种癌症患者的一年生存率极低,其治疗进展也落后于许多其他癌症。在一项近日发表在《Nature Medicine》上的最新研究中,来自美国犹他大学(UU)亨斯迈癌症研究所(HCI)的研究人员发现了一种治疗胰腺癌患者的新策略。

图片来源:Nature Medicine
过去的研究已经发现只通过KRAS的角色或者影响自噬来治疗胰腺癌是无效的。在这项HCI新研究中,研究人员利用两种药物同时靶向了KRAS信号和自噬过程,结果在小鼠模型和病人身上都观察到了显著的疗效。HCI的医学科学家、UU内科医学教授Conan Kinsey博士和HCI癌症研究人员、UU皮肤医学教授Martin McMahon博士一起领导了这项研究。
研究人员发现一种联合疗法可以更有效治疗这种癌症。HCI的研究人员第一次在实验室动物模型和第一个临床病人身上观察到了这种疗法的抗癌效果。这项研究目前已经在HCI进行临床试验,不久将对美国全国开放。这项临床试验叫做THREAD,国家临床试验批号为03825289。该联合疗法同时使用两种美国FDA批准的药物治疗其他疾病,包括癌症,这项新的联合药物以口服药片的形式服用。
8.Oncotarget:超级增强子——治疗胰腺导管腺癌的新靶点!
doi:10.18632/oncotarget.26704
研究人员近日在包括c-MYC、MED1、OCT-4、NANOG和SOX2等基因的增强子区域发现了微小的H3K27AC标记,可以作为非癌的、癌性的以及转移性胰腺导管腺癌(Pancreatic ductal adenocarcinoma,PDAC)细胞系中的基因簇的一种超级增强子(super-enhancers,SE)。 在这项最新研究中,研究人员揭示了PDAC小鼠模型的进展过程中转录和增强子的改变是如何发生的。因此癌症研究迫切需要找到可以靶向和疾病进展相关的增强子的新型治疗药物。
主转录因子OCT4、SOX2和NANOG在鼠源胚胎干细胞基因组中的共定位是增强子活性的预测因子。由于细胞信号通路中现存的缺陷允许癌细胞改变它们增殖、转录 、生长、迁移、分化和死亡的方式,因此发现癌细胞增殖和生存依赖于SE驱动的转录为靶向癌细胞提供了一个新的治疗靶点。
9.Nature:几十年秘密终破解!揭示胰腺癌的两种独特的产生和生长方式
doi:10.1038/s41586-019-0891-2
在一项新的研究中,为了研究胰腺癌的起源,英国弗朗西斯克里克研究所的Hendrik Messal博士及其团队开发出一种新型方法,从而在三维水平下分析癌症活组织样本。这种技术揭示出胰腺癌是在胰腺导管壁中产生的,而且依赖于胰腺导管的尺寸,向内或向外生长。这就解释了几十年来人们在胰腺癌的二维切片中观察到的神秘形状差异。相关研究结果发表在2019年2月7日的Nature期刊上,论文标题为“Tissue curvature and apicobasal mechanical tension imbalance instruct cancer morphogenesis”。
通过在三维水平下分析胰腺癌的产生过程,这些研究人员确定了两种不同类型的起源自导管细胞的胰腺癌形成:在胰腺导管内部生长的“内生性(endophytic)”肿瘤和向胰腺导管外部生长的“外生性(exophytic)”肿瘤。为了找出癌细胞以特定方式生长的原因,他们分析了详细的三维图像,并且与构建了复杂计算机模型的生物物理学家合作。
论文共同作者Silvanus Alt 博士说,“我们对胰腺导管进行了模拟,描述了单个细胞的几何形状以便了解组织形状。这种模型和实验结果均证实当胰腺导管直径小于约20微米(大约为五十分之一毫米)时,癌症会向外生长。”
10.PNAS:为何胰腺癌对现有的免疫检查点抑制剂不感冒?关键在于VISTA过度表达!
doi:10.1073/pnas.1811067116
免疫检查点阻断药物(也称为免疫检查点抑制剂)通过阻断T细胞表面上的免疫检查点PD-1和CTLA-4来对癌症发起免疫攻击,可有效地治疗很多癌症。但是,到目前为止,作为最致命的癌症之一,胰腺癌对免疫检查点阻断药物治疗的抵抗性是出了名的。胰腺癌患者的五年存活率为7%或更低。

对人胰腺瘤中的CD68、PD-L1和VISTA表达进行CyTOF分析。图片来自PNAS, 2019, doi:10.1073/pnas.1811067116。
在一项新的研究中,来自美国德克萨斯大学MD安德森癌症中心的研究人员鉴定出一个潜在新的免疫治疗靶标。他们发现免疫检查点VISTA在浸润到胰腺瘤中的免疫细胞(特别是巨噬细胞)中过量表达。相关研究结果于2019年1月10日在线发表在PNAS期刊上,论文标题为“Comparison of immune infiltrates in melanoma and pancreatic cancer highlights VISTA as a potential target in pancreatic cancer”。论文通讯作者为德克萨斯大学MD安德森癌症中心泌尿外科肿瘤学与免疫学教授Padmanee Sharma博士和德克萨斯大学MD安德森癌症中心免疫学系主任Jim Allison博士。
Sharma说,“VISTA是胰腺癌的一个潜在治疗靶标,有几种阻断VISTA的抗体正在临床开发之中。还需要开展进一步的研究来看看我们是否能够为这些VISTA阳性细胞找到其他的治疗靶标。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


