Nature子刊:薛璐璐等开发硅氧烷基LNP,实现mRNA的器官特异性高效递送
来源:生物世界 2024-10-05 10:59
该研究提供了概念验证,表明在类脂质结构中引入硅氧烷基团,可以在体内实现LNP器官靶向的调节,从而为开发下一代组织特异性mRNA递送的脂质样材料奠定了基础。
宾夕法尼亚大学 Michael J. Mitchell 团队(薛璐璐、赵干、宫宁强为共同第一作者)在 Nature 子刊 Nature Nanotechnology 上发表了题为:Combinatorial design of siloxane-incorporated lipid nanoparticles augments intracellular processing for tissue-specific mRNA therapeutic delivery 的研究论文。
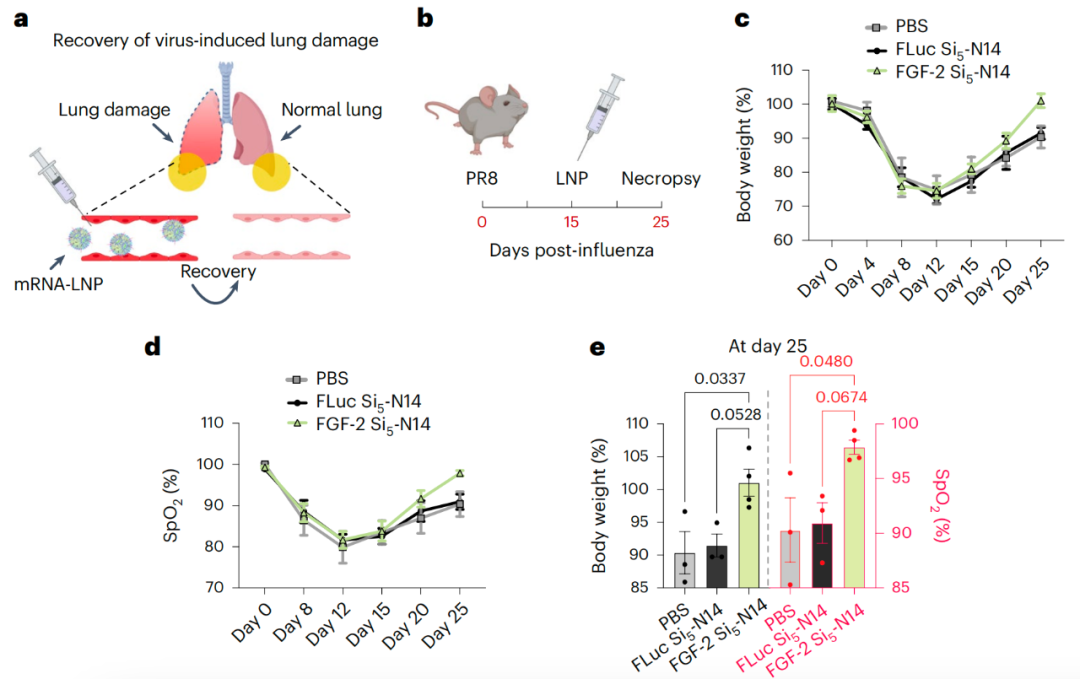
该研究设计了一类具有不同结构的基于硅氧烷的可电离脂质(类脂质),并配制了含硅氧烷的LNP——SiLNP,以调控mRNA在体内向肝脏、肺和脾脏的递送。硅氧烷的存在增强了mRNA-LNP的细胞内化,并提高了其胞内逃逸能力,从而提高mRNA递送效率。研究团队进一步验证了器官特异性利用器官特异性SiLNP递送CRISPR基因编辑组分,在小鼠肝脏及肺部实现了稳健的基因敲除。此外,该研究还显示,Si5-N14 LNP通过递送成纤维细胞生长因子-2(FGF-2)的mRNA,有效恢复了病毒感染引起的肺损伤。
研究团队表示,该研究开发的SiLNP有助于将mRNA疗法应用于下一代组织特异性的蛋白质替代疗法、再生医学和基因编辑的临床转化,预示着个性化医学和基因治疗的新时代即将到来。

由于硅氧烷(含有Si-O-Si键的化合物)复合材料具有高稳定性、低化学活性和良好的生物相容性等特点,因此,研究团队采用组合设计方法合成了252个(12×21)含有不同硅氧烷胺核心成分和烷基链结构的类脂化合物库,其中每个含硅氧烷的类脂体用Six-Cy、Six-Oy或Six-Ny表示,其中“x”表示每个类脂质中硅氧烷胺头部的数量,“y”表示不同烷基链的长度,例如Si5-N14。
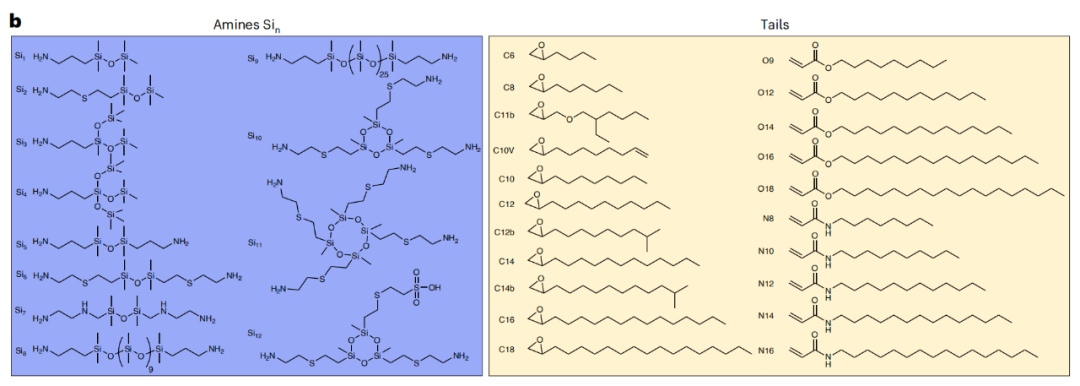
这些含硅氧烷的类脂质被用于制备含硅氧烷的LNP(SiLNP),以证明结构引导的体内系统性mRNA递送。
研究团队发现,将硅氧烷基团引入类脂质结构,不仅可以增强mRNA-LNP的内吞作用,还可以提高其从内体中逃逸的能力,从而提高mRNA的递送效率。在小鼠体内的评估显示,含硅氧烷的类脂质的结构发生轻微改变就能够显著改变其组织亲和性。例如,Si6-C14b靶向肝脏、Si5-N14靶向肺,Si12-C10靶向脾脏,这些SiLNP显示出器官特异性转染各种类型的细胞,包括肝细胞,Kupffer细胞,内皮细胞、树突状细胞和脾脏巨噬细胞。
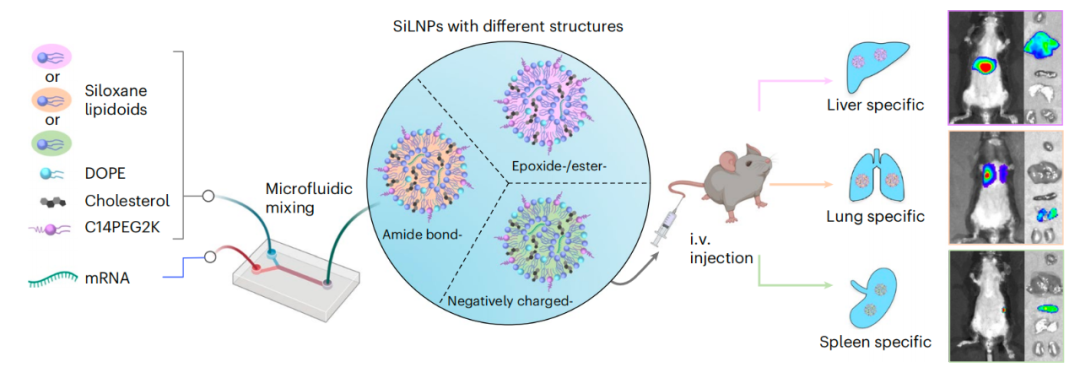
使用肝脏靶向的SiLNP(Si6-C14b LNP)和肺靶向SiLNP(Si5-N14),递送CRISPR-Cas9基因编辑器组分,在野生型小鼠的肝脏,以及转基因GFP小鼠和Lewis肺癌荷瘤小鼠的肺部,实现稳健的基因敲除。
此外,在病毒性肺炎中,肺血管内皮的损伤对肺功能的恢复至关重要,其再生与修复是决定患者愈后的关键因素。基于硅氧烷LNP对血管内皮细胞的高度亲和性,研究团队率先将这一系统应用于肺再生医学的研究。结合临床患者样本和小鼠病毒性肺损伤模型,研究揭示了两种关键微环境信号在肺血管内皮修复中的新机制:TGF-β1和LRG-1协同调控SMAD信号传导,通过Si7-N12 LNP递送vegfa mRNA促进血管内皮再生。该工作于2024年1月31日发表于 Science Translational Medicine 期刊【2】。
同时,在这项最新研究中,研究团队还验证了通过精准Si5-N14 LNP递送Fgf-2等关键内皮生长因子促进病毒感染肺损伤模型的血管修复,展示了基于该递送系统的靶向血管内皮治疗疾病的潜在临床应用潜力。
该研究提供了概念验证,表明在类脂质结构中引入硅氧烷基团,可以在体内实现LNP器官靶向的调节,从而为开发下一代组织特异性mRNA递送的脂质样材料奠定了基础。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


