蚯蚓高质量基因组揭示其全球分布与生态可塑性的分子机制
来源:生物谷 2021-02-19 14:45
达尔文在晚年的时候,开启了一段看似平淡却又独特的研究,研究的对象就是隐伏于地下的蚯蚓,并在1881年出版的《腐殖土的形成和蚯蚓的作用》中得到了一个耐人寻味的论断“我们很难找到其他的生灵像它们一样,虽看似卑微,却在世界历史的进程中起到了如此重要的作用”。基于一系列巧妙的实验,达尔文敏锐地发现土壤的形成与蚯蚓的长期作用是分不开的。在后来,越来越多的科学家发现蚯蚓
达尔文在晚年的时候,开启了一段看似平淡却又独特的研究,研究的对象就是隐伏于地下的蚯蚓,并在1881年出版的《腐殖土的形成和蚯蚓的作用》中得到了一个耐人寻味的论断“我们很难找到其他的生灵像它们一样,虽看似卑微,却在世界历史的进程中起到了如此重要的作用”。基于一系列巧妙的实验,达尔文敏锐地发现土壤的形成与蚯蚓的长期作用是分不开的。在后来,越来越多的科学家发现蚯蚓的存在可以显著提升土壤的质量,降低土壤毒素,增加土壤微生物群落的多样性。这个被达尔文视为卑微却又伟大的“土壤工程师”和人类协作了几千年,帮助人类更高效地从土地获取食物。

蚯蚓是一类种数超过3000并广布于地球陆地各个生态区的土壤动物。超强的生存力和对环境的适应能力是这类机体结构如此简单的无脊椎动物能够衍生到今天,并成为地球生物多样性重要组成部分的基础。其中,Amynthas corticis是一类起源于东亚并通过物理传播入侵到其他各地的世界广布种蚯蚓,有研究认为该种蚯蚓的入侵性是与其独特的基因组特征(多倍体)和生殖方式(孤雌生殖)相关的。多倍体可以为蚯蚓提供更多用于演化或表达优势性状的基因组材料,而孤雌生殖则可以帮助蚯蚓更稳定地遗传这些性状。另一方面,蚯蚓与其肠道微生物以及土壤存在非常紧密的互作关系,基于这种互作关系蚯蚓可以改变土壤中各组分比例(丰富土壤营养、降低土壤的重金属等污染),并优化土壤微生物群落结构(提高有益菌比例、降低有毒微生物比例),既可以改善土壤质量,也可以使自身在土壤复杂的环境中成功的生存下来。这些独特现象的分子机制都编码在蚯蚓的基因组中,然而目前连一个完整的野生蚯蚓种基因组都尚未见报道,更无从谈起对蚯蚓适应变化环境的分子机制进行探索。
为了解决这个问题,中国农业大学资源与环境学院孙振钧教授课题组,基于长读段三代测序与Hi-C测序相结合的策略,对蚯蚓基因组进行了高质量拼装,形成了一个长达1.2 Gb,包含42条准染色体序列的基因组。蚯蚓基因组拼装序列的N50长度达到31 Mb,结合转录组测序数据共预测出29,256个蛋白质编码基因,且91.2%的后生动物单拷贝直系同源基因都在该基因组中存在完整匹配,证明该基因组具有较高的完整性。完整的基因组,为深入探究隐藏在蚯蚓物种独特性背后的分子机制提供了先决条件。该工作以“Amynthas corticis genome reveals molecular mechanisms behind global distribution”为题发表在Nature子刊Communications Biology上,并被选为封面文章。中国农业大学王兴副教授为文章第一作者,共同第一作者是中国农业大学毕业生张一博士、张玉峰博士和康明明博士。中国农业大学孙振钧教授为文章通讯作者,共同通讯作者是中国农业大学王兴副教授和中国农业大学毕业生赵义博士。其他作者包括中国农业大学毕业生李元博、姜昊、毕艳孟博士、北京晶科瑞医学检验实验室有限公司杨扬以及美国玛赫西管理大学的Samuel W. James教授。

Figure 1 蚯蚓基因组概览
该研究首先回答了蚯蚓基因组的倍性问题。对若干蚯蚓个体的高深度重测序数据显示,蚯蚓基因组中的单核苷酸多态性存在两个频率峰值,分别是1/3和2/3,说明蚯蚓的双等位基因在基因组中具有三个拷贝。另外,从重测序读段中提出的杂合k-mer序列的基因组覆盖分布上来看,高达88%的数据支持杂合k-mer序列的总体覆盖度是3n,而包含单核苷酸多态性k-mer序列的标准化覆盖度是1/3,从另一个角度证明了蚯蚓的三倍体特征。为了直接观察到蚯蚓基因组的染色体数目,本研究进行了核型分析,发现蚯蚓具有多于120条的染色体,如此巨大的染色体数目更直观地显示出蚯蚓的三倍体特征。三倍体生物在减数分裂过程中,其染色体无法进行正常联会,因此该倍性特征也支持蚯蚓的孤雌生殖方式。有意思的是,与Amynthas corticis这个世界广布种不同,一些区域性分布的蚯蚓,如Eisenia fetida和Eisenia andrei,它们都是二倍体生物。这种蚯蚓基因组倍性的多样性是否与其自然分布特征存在一定的关联性,还有待进一步的研究。
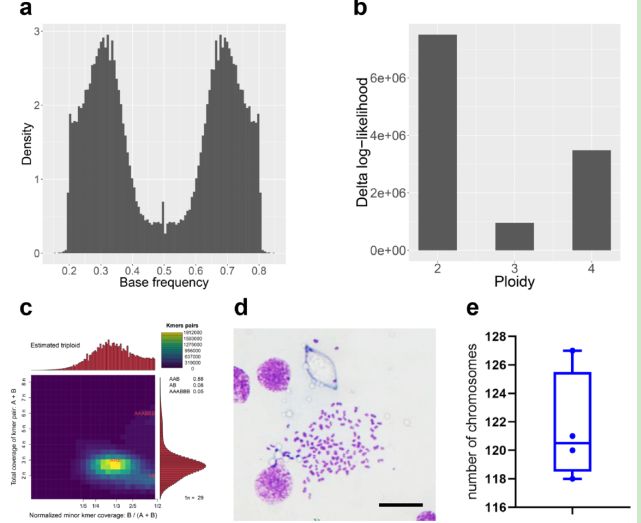
Figure 2 蚯蚓基因组三倍体特性分析。a, 蚯蚓基因组单核苷酸多态性位点频率分布。b, 蚯蚓基因组倍性最大似然法统计检验。c, 蚯蚓基因组杂合k-mer序列基因组覆盖分布。d, 蚯蚓染色体核型分析。e,蚯蚓染色体数目统计。
蚯蚓在具有充足基因组材料的基础上,沿着怎样的演化路径加强了它应对外界环境的适应能力呢?该研究基于对物种谱系基因家族演化分析发现,蚯蚓为了更好的环境适应能力,走了一段与其他环节动物相比截然不同的演化之路。首先,蚯蚓基因组的大小分别是其他环节动物海蠕虫(Capitella teleta)的3.87倍和水蛭(Helobdella robusta)的5.49倍,说明蚯蚓的整体演化策略是基因组扩张。更奇特的是,对物种谱系中加速演化的基因家族进行相关性以及PCA分析后发现,蚯蚓与海蠕虫以及水蛭具有很大差异,这种差异使得蚯蚓已经离开了环节动物的范畴。更细致的分析发现,造成蚯蚓和其他环节动物巨大差异的主要驱动力是与环境适应相关基因家族的加速演化,这些基因家族的功能涉及免疫系统过程(immune system process),胁迫应激(response to stress)和稳态过程(homeostatic process)。而且,基因家族的演化在蚯蚓内部产生了分歧,与Eisenia fetida和Eisenia andrei相比,Amynthas corticis中与环境适应相关基因家族的演化更加剧烈。这种剧烈的演化也许给蚯蚓的全球分布提供了必要的遗传基础。
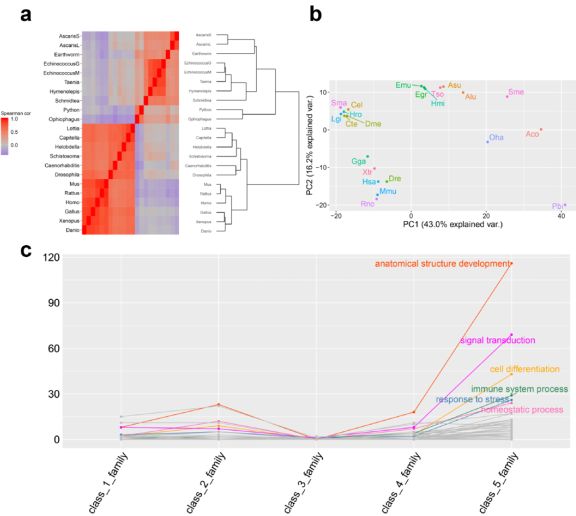
Figure 3 蚯蚓非比寻常的演化之路。a, 加速演化基因家族物种谱系间相关性分析。b, 加速演化基因组家族物种谱系PCA分析。c, 加速演化基因家族功能富集分析。
其实,科学家在探索蚯蚓环境适应能力背后分子机制的道路上从未停留,克隆并细致研究了很多功能性基因。蚯蚓基因组的完整拼装,为在基因组框架下系统性地研究这些基因的分布、物种多样性以及功能相关性上提供了前提条件。该研究对蚯蚓的细胞溶解酶(包括fetidin、lysenin和coelomic cytolytic factor),抗菌蛋白(包括lumbricin I、LBP/BPI和lysozyme),具有先天免疫功能的toll-like受体(包括mccTLR和sccTLR),氧胁迫应激蛋白(包括SOD,CAT和CRT),金属胁迫应激蛋白(PCS),异生物质解毒蛋白(包括GST和CYP450)和热应激蛋白(HSP70)在基因组中进行了系统的鉴定,发现它们倾向出现在基因组倍增区域,并具有更高的基因家族扩张趋势,这为蚯蚓适应环境提供了充足的分子基础。另一方面,包含这些基因的基因组区域更富集单核苷酸多态性位点,预示着这些基因具有更高的种内多样性,使其在不同细分生境中更灵活地发挥功能,也为这些基因的持续演化提供了丰富的突变原材料。
Figure 4 蚯蚓抗逆基因的基因组分布
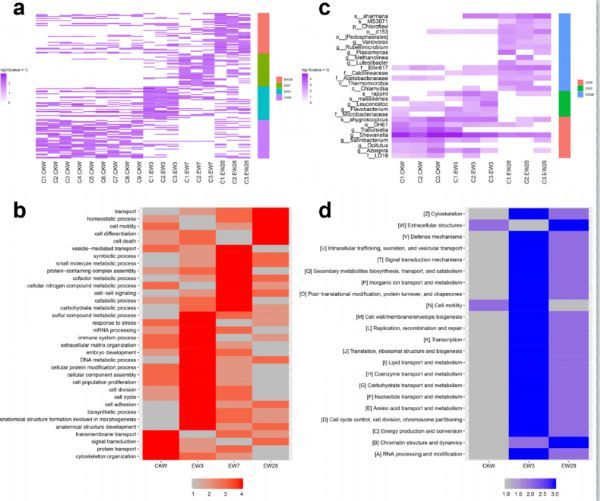
接下来,该研究试图解析蚯蚓与其肠道微生物以及土壤紧密互作的分子机制。为了清晰展现出互作的过程,将蚯蚓放置在被有毒大肠杆菌(Escherichia coli O157:H7)污染的土壤中生长,然后分别在置入前和置入后3天、7天以及28天等四个时间点获取蚯蚓的体壁及肠道微生物样本,进行蛋白质谱检测以及16S rDNA测序,揭示蚯蚓如何调动自身基因组与其肠道微生物应对土壤环境的胁迫。
蛋白质谱检测结果显示,蚯蚓在四个时间点中都高表达了具有不同功能特征的基因,而这些基因的功能又彼此联系,展现出精准的时序调控:在置入到污染土壤之前,蚯蚓中高表达基因与细胞基础功能相关,包括细胞骨架组织(cytoskeleton organization)、蛋白质运输(protein transport)、跨膜运输(transmembrane transport)和信号转导(signal transduction),说明此时蚯蚓处于正常的生理状态;在置入到污染土壤3天后,蚯蚓中高表达基因与防御功能以及细胞群体行为相关,包括胁迫应激(response to stress)、免疫系统过程(immune system process)、细胞群体增殖(cell population proliferation)和细胞粘连(cell adhesion),说明此时蚯蚓已经开始动员基因组中的抗逆基因应对环境的胁迫,尤其是基于细胞功能的防御机制;在置入到污染土壤7天后,蚯蚓中高表达基因与代谢分解过程和生物体共生过程相关,包括糖类代谢过程(carbohydrate metabolic process)、小分子代谢过程(small molecule metabolic process)、辅酶代谢过程(cofactor metabolic process)、胞源氮化合物代谢过程(cellular nitrogen compound metabolic process)、分解过程(catabolic process)和共生过程(symbiotic process),说明此时蚯蚓已经开始采用基于体液功能的防御机制应对环境胁迫,也表明此时蚯蚓肠道微生物与蚯蚓的互作发生了增强;在置入到污染土壤28天后,蚯蚓中高表达基因与稳态过程(homeostatic process)相关,表明在经历了一系列应激反应后,蚯蚓已经适应了污染土壤,并开始重新构建生物体内的稳定状态。
Figure 5 蚯蚓在逆境中对基因组进行精准的时序调控。a, 不同时间点蚯蚓基因组高表达基因分布。b, 不同时间点蚯蚓肠道高丰度微生物分布。c, 不同时间点蚯蚓基因组高表达基因功能分布。d, 不同时间点蚯蚓肠道高丰度微生物功能分布。
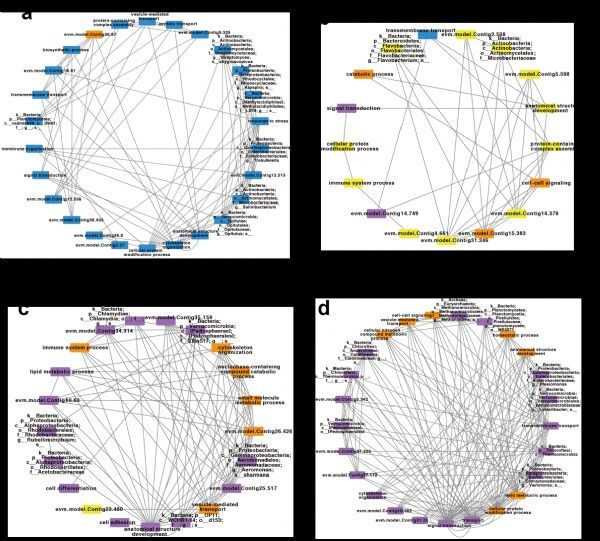
当基于蛋白的表达强度以及肠道微生物16S rDNA丰度构建互作网络的时候,该研究发现了4个互作网络,均反映出在蚯蚓和蚯蚓肠道微生物之间存在较强的协同效应,共同维持着蚯蚓在不同时间点的生理需求。第一个互作网络中,有96%的网络组分(包括蚯蚓基因以及蚯蚓肠道微生物)在蚯蚓被置入污染土壤之前具有最高的表达或丰度,其功能与代谢和应激相关,显示出蚯蚓在正常环境下的生理状态。第二个互作网络中,有65%的网络组分在蚯蚓被置入污染土壤3天后具有最高的表达或丰度,其功能与免疫系统过程以及抗病性激活相关,说明这个互作网络是蚯蚓受到致病性大肠杆菌刺激后形成并在应对胁迫的起始过程中发挥作用。第三个互作网络中,有95%的网络组分在蚯蚓被置入污染土壤7天或28天后具有最高的表达或丰度,其功能与各类防御过程、细菌素合成以及免疫功能调节相关,说明这个互作网络在蚯蚓应对胁迫过程中发挥核心功能。第四个互作网络中,有72%的网络组分在蚯蚓被置入污染土壤28天后具有最高的表达或丰度,其功能与稳态过程以及生物体修复相关,表明这个互作网络在蚯蚓应对胁迫后,恢复生理机能的过程中发挥重要作用。
Figure 6 蚯蚓基因组与肠道微生物互作网络。a, 蚯蚓被置入污染土壤前特征性互作网络。b, 蚯蚓被置入污染土壤3天后特征性互作网络。c, 蚯蚓被置入污染土壤7天与28天后特征性互作网络。d, 蚯蚓被置入污染土壤28天后特征性互作网络。
该研究通过对蚯蚓基因组的完整拼装与多组学分析,揭示了世界广布种蚯蚓Amynthas corticis基因组的三倍体特征及其与肠道微生物、土壤紧密互作的分子机制,并为后续研究提供了丰富且多元的数据资源。基因组的解析,仅仅是撩开了这个卑微却又伟大的“土壤工程师”神秘面纱的一个边角,更多的奥秘还有待深入且细致的研究来揭示。
“蚓无爪牙之利,筋骨之强,上食埃土,下饮黄泉,用心一也”,就像默默无闻却又韧性十足的蚯蚓一样,中国农业大学孙振钧教授几十年如一日潜心研究蚯蚓,现在是世界蚯蚓产业联盟(筹)主席,这次成功破译基因组又为世界蚯蚓研究领域做出重要贡献。基因组的破译只是个开端,蚯蚓的神奇还值得更加深入地挖掘,就像菲尔普斯在《了不起的地下工作者》书中写的那样:“如果我们对蚯蚓的态度认真起来,把脚下的土壤,而不是我们头顶上的天空,作为我们精神的寄托和最终肉体的归宿,我们的生命将会有怎样的变化呢?看起来我们一直在这个问题上看错了方向”。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。