它竟是压力与抑郁背后的秘密操纵者!最新研究表明:压力通过影响肠道中的布氏腺活动,改变肠道菌群平衡,对大脑和免疫系统造成影响
来源:生物谷原创 2024-08-22 09:50
研究显示,心理压力可通过改变大脑中的神经活动,抑制布氏腺功能,从而减少肠道中乳酸杆菌的数量,增加感染易感性,最终影响免疫力。
在我们日常生活中,很多时候都会感觉到心里有股无形的压力,就像是背了个沉甸甸的包袱,让人喘不过气来。这种压力可能来自工作、学习、人际关系或是生活中的各种挑战。当我们心里装满这些烦恼时,身体也会悄悄地给出反应,尤其是我们的肠胃系统。
比如有的人在考试或者面试之前会紧张得拉肚子,有的人会胀气打嗝。
长期以来,我们都知道心情和肠胃健康之间有着紧密的联系。心理压力大的时候,就像给肠胃发了个“紧急信号”,让它们也跟着紧张起来,导致消化液分泌不正常,肠胃蠕动变得不规律,最终就出现了各种肠胃问题。
不过心理压力对肠胃的影响可不止这些,它还会影响肠道菌群,后者又会反过来影响我们的大脑和免疫系统。心理压力、大脑、肠道、免疫系统之间的关系似乎是剪不断理还乱,不过最新的研究让它们这种错综复杂的关系慢慢变得清晰。
肠道中的压力感应器:布氏腺
最近著名的《细胞》杂志上发表了一项题为“Stress-sensitive neural circuits change the gut microbiome via duodenal glands”的研究,由西奈山伊坎医学院的研究团队揭示了压力敏感神经回路与肠道微生物群变化之间的联系。

研究团队特别关注了十二指肠中的布氏腺,这些特殊的腺体负责促进肠道中对人体有益的乳酸杆菌的增殖。科学家们通过一系列尖端技术,包括单核测序、消融研究、活体成像、电生理记录和行为测定,精心剖析了连接大脑与肠道微生物群的神经通路。
研究人员构建了一个小鼠模型,专门在布氏腺中表达荧光钙指示剂,这样他们就能观察到布氏腺在迷走神经刺激下的活动情况。他们发现,迷走神经信号对于在布氏腺中引发强烈的钙瞬变和黏液分泌至关重要,这凸显了迷走神经在调节肠道微生物稳态中的关键作用。
研究团队发现,慢性压力会抑制大脑中负责情绪处理的中央杏仁核的活动,导致一系列影响布氏腺功能的连锁反应。这种抑制最终导致肠道中乳酸杆菌数量减少,感染易感性增加。
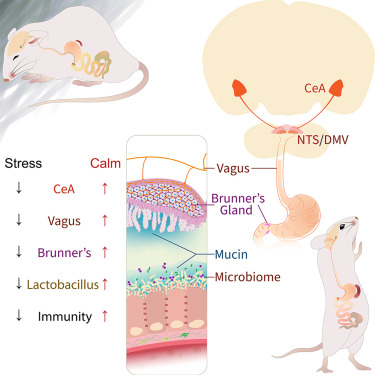
图注:布氏腺(十二指肠腺)的分泌物通过促进胃肠道中乳酸杆菌的增殖来增强宿主的防御能力
相反,当人为激活中央杏仁核或副交感神经的迷走神经元时,布氏腺的分泌功能就得到恢复,从而逆转了压力对肠道微生物群和免疫力的有害影响。这说明大脑与身体之间存在直接的相互作用机制,通过该机制,心理状态通过肠道微生物群影响宿主的防御机制。
虽然之前就有研究表明压力会影响肠道菌群,但其中的机理一直没有明确。而这项研究是第一次阐明了布氏腺的作用。随着对于肠-脑轴的研究逐步深入,科学家们慢慢搞清楚了肠道菌群、大脑和心理压力之间的关系。
微生物如何塑造我们的压力反应?
今年早些时候,发表在《大脑、行为与免疫 – 健康》期刊上的一项研究中,研究人员揭示了肠道微生物群与压力适应性之间的关键联系,为抑郁症和焦虑症等潜在新疗法的开发提供了重要线索。

实验主要围绕小鼠在压力下的行为展开,重点研究了肠道微生物群对生物体抗压能力的影响。那些对压力敏感的小鼠,它们的结肠中表现出更高的通透性和更强的免疫反应,同时血清中的促炎细胞因子水平也升高。特别值得注意的是,这些小鼠的海马体表现出更高程度的小胶质细胞激活、小胶质细胞与神经元之间的异常相互作用以及突触可塑性降低。
研究还发现,与压力敏感型的小鼠相比,抗压型小鼠的肠道中乳酸杆菌和阿克曼氏菌的含量更高,而拟杆菌、拟普雷沃菌和其他一些细菌菌株的含量更低。
如果从压力敏感型的小鼠体内提取粪便微生物群,并移植到未接触过压力的小鼠体内,就会破坏后者大脑中的小胶质细胞与神经元之间的相互作用,损害海马体的突触可塑性,从而让这些小鼠受到压力后表现出抑郁的症状。相反,从抗压型小鼠体内提取的粪便微生物群,如果移植到未接触过压力的小鼠体内,就可以保护后者脑中的小胶质细胞免于激活,这就保持了其海马体的突触可塑性,从而减轻抑郁症状。
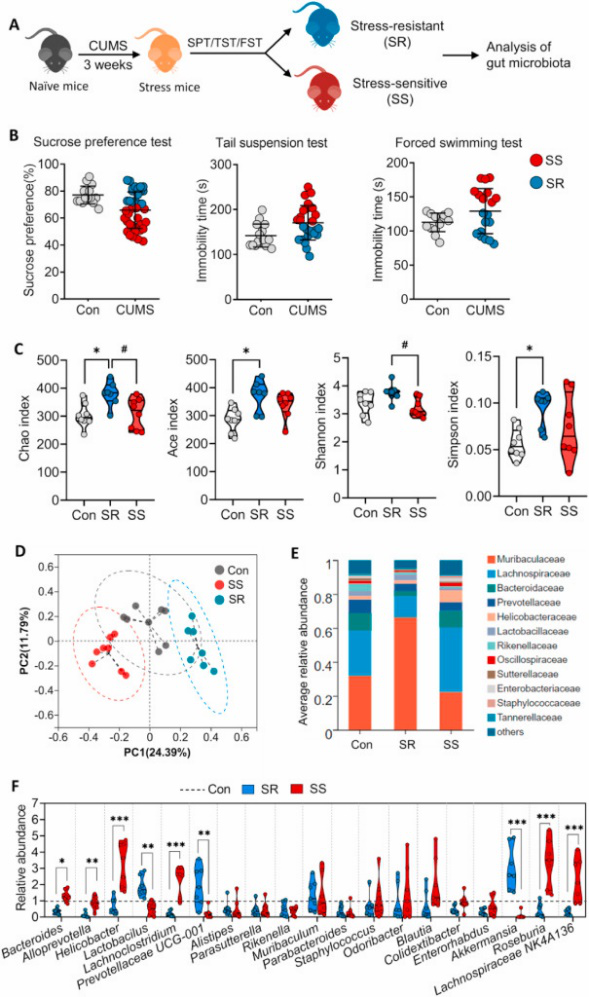
图注:抗压力小鼠、压力敏感小鼠和未经受压力的小鼠的肠道菌群特征
此外,他们还发现压力引起的肠道通透性变化使得代谢产物能够进入大脑,激活小胶质细胞并破坏小胶质细胞与神经元之间的相互作用,最终影响海马体的突触传递和行为。
这些发现凸显了肠道微生物群在应对压力方面的关键作用,并为针对抑郁症、焦虑症和压力相关疾病的新型疗法提供了潜在的途径。
另一方面,肠道微生物也会直接引发抑郁症,不过这种抑郁症和由心理压力引起的抑郁症有所不同。
肠道菌群:抑郁症治疗的新靶点
最近发表在《基因》期刊上的一项研究中,重庆医科大学附属第一医院的研究人员揭示了肠道微生物群如何可能影响抑郁症的病程发展。

他们发现与传统压力源引起的抑郁症机制相比,肠道微生物引起的抑郁症机制存在显著差异。肠道微生物群引起的抑郁症主要与适应性免疫反应有关。这意味着肠道菌群的变化可以引发免疫系统的反应,进而影响大脑功能和情绪。这个途径涉及特定的免疫细胞和抗体,它们会适应并响应肠道环境的变化,影响大脑的炎症过程。
此外,研究人员通过KEGG(Kyoto Encyclopedia of Genes and Genomes,京都基因和基因组百科全书)分析发现,免疫-炎症反应是肠道微生物群失调导致抑郁症的关键因素。这意味着肠道微生物引发的某些细胞对炎症的反应可能是导致情绪障碍的主要原因。
另一方面,生理和心理压力引起的抑郁症与先天免疫系统更为密切相关。与适应性免疫不同,先天免疫系统能够产生对压力的即时、非特异性反应,表明在抑郁症中有不同的免疫类型参与。这包括激活不针对特定病原体但广泛且普遍的免疫反应。研究还发现,传统压力通过调节能量代谢和神经递质来影响抑郁症。
因此,了解肠道-大脑轴在抑郁症中的作用,可能为开发基于微生物群的治疗方法铺平道路。尽管之前关于益生菌的临床试验结果不一,但这项研究为更精确和有效的治疗策略奠定了基础。这些发现可能通过根据抑郁症的病因确定特定的治疗靶点,来推动抑郁症的精确治疗。
小结
肠道微生物群在心理健康中扮演关键角色,尤其是与心理压力和大脑功能的相互作用密切相关。研究显示,心理压力可通过改变大脑中的神经活动,抑制布氏腺功能,从而减少肠道中乳酸杆菌的数量,增加感染易感性,最终影响免疫力。反之,健康的肠道微生物群也有助于提高抗压能力,改善心理状态。例如,抗压力小鼠体内含有更高比例的乳酸杆菌和阿克曼氏菌,这与较低的压力反应和更好的情绪管理相关。此外,肠道微生物失调还可能是抑郁症的重要诱因,涉及复杂的免疫-炎症反应。为改善这一状况,我们在日常生活中应注重均衡饮食,促进肠道健康,并通过运动和积极的生活方式管理压力,以维护整体的身心健康。
参考文献:
1. Chang H, Perkins MH, Novaes LS, Qian F, Zhang T, Neckel PH, Scherer S, Ley RE, Han W, de Araujo IE. Stress-sensitive neural circuits change the gut microbiome via duodenal glands. Cell. 2024 Aug 1:S0092-8674(24)00779-7. doi: 10.1016/j.cell.2024.07.019.
2. He H, He H, Mo L, Yuan Q, Xiao C, Ma Q, Yi S, Zhou T, You Z, Zhang J. Gut microbiota regulate stress resistance by influencing microglia-neuron interactions in the hippocampus. Brain Behav Immun Health. 2024 Jan 23;36:100729. doi: 10.1016/j.bbih.2024.100729.
3. Chen X, Mo X, Zhang Y, He D, Xiao R, Cheng Q, Wang H, Liu L, Li WW, Xie P. A comprehensive analysis of the differential expression in the hippocampus of depression induced by gut microbiota compared to traditional stress. Gene. 2024 Nov 15;927:148633. doi: 10.1016/j.gene.2024.148633.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


