Nature Methods:保留天然环境,精准提取膜蛋白:膜活性聚合物纳米盘(Nanodiscs)平台的革命性进展
来源:生物探索 2024-12-04 09:33
这项基于纳米盘的膜蛋白提取平台,不仅在技术上实现了突破,也为膜蛋白研究开辟了新的方向。
膜蛋白(Membrane Proteins,MPs)是细胞功能的核心组成部分,广泛参与细胞信号传导、物质运输、能量转化等至关重要的生物学过程。然而,膜蛋白的研究一直面临着一项巨大的挑战:如何在不破坏其天然环境的前提下,提取和研究这些重要的蛋白质。传统的研究方法使用去膜剂(Detergents)破坏细胞膜,从而提取膜蛋白,但这一过程会剥离膜蛋白所依赖的天然膜环境,导致其功能丧失或失真。如何突破这一技术瓶颈,一直是生命科学和药物开发领域的难题。
11月28日发表于Nature Methods的研究“A proteome-wide quantitative platform for nanoscale spatially resolved extraction of membrane proteins into native nanodiscs”,开发了一项创新性技术为膜蛋白研究提供了新的解决方案:纳米盘(Nanodiscs)平台。这项技术通过使用特殊的聚合物库,能够在保持膜蛋白天然环境的同时,将膜蛋白从细胞膜中高效提取出来。纳米盘不仅能将膜蛋白稳定地包裹在类似天然膜的微小圆盘结构中,还能大幅提高膜蛋白提取的效率和纯度。通过这一技术,研究人员能够更精确地研究膜蛋白的结构、功能及其与其他分子的相互作用,进一步揭示膜蛋白在细胞中的生物学作用。
这项技术的创新意义远超基础研究,它为药物研发、疾病治疗提供了崭新的视角和工具。膜蛋白是许多疾病的关键靶点,而在其天然膜环境中的精准研究,可能为开发更有效、更具针对性的药物开辟新的道路。随着该平台的推广和完善,膜蛋白的研究将迎来一个全新的时代,为生命科学带来更加深入的探索和理解。

传统的膜蛋白提取方法使用去膜剂(Detergents)破坏细胞膜,虽然能够提取膜蛋白,但也剥离了膜蛋白的天然环境,限制了研究的深度和准确性。为了克服这一问题,研究团队开发了一种基于聚合物的纳米盘平台,通过该平台,膜蛋白能够直接从细胞膜中提取出来,并且保持其天然的膜环境。该平台的核心创新在于使用了一种具有膜活性的聚合物库(Library of membrane-active polymers)。这些聚合物能够有效地将膜蛋白包裹在纳米盘中,形成稳定的复合物。与传统的去膜剂方法相比,这种方法避免了破坏膜蛋白的天然环境,能够更好地保留膜蛋白的结构和功能。
纳米盘是一种由磷脂双层(Phospholipid Bilayer)构成的小型圆盘结构,能够模拟细胞膜的天然环境。纳米盘的形成是通过特殊的聚合物(如苯乙烯-马来酸共聚物(Styrene-Maleic Acid Copolymers,SMA))将膜蛋白包裹在其内,形成稳定的膜蛋白复合物,从而在不破坏膜蛋白天然结构的情况下实现提取。具体来说,纳米盘技术的工作原理可以分为以下几个步骤:
聚合物选择与膜蛋白包裹:首先,研究人员选择了适合膜蛋白的聚合物,这些聚合物通常是膜活性聚合物,能够与膜蛋白和脂质双层相互作用。常用的聚合物包括苯乙烯-马来酸共聚物(SMA)和其他与膜结合的高分子材料。聚合物通过与膜蛋白和脂质双层的相互作用,将膜蛋白从细胞膜中提取出来。
纳米盘的形成:聚合物与膜脂质和膜蛋白结合后,形成一个类膜结构的小圆盘,即纳米盘(Nanodisc)。这种结构能够保持膜蛋白的天然膜环境,避免去膜剂的干扰。
膜蛋白提取与纯化:通过纳米盘的包裹,膜蛋白被稳定地提取到纳米盘中。提取后的膜蛋白保留了其功能状态,可以进一步进行各种分析,如结构解析、功能检测等。由于纳米盘具有高稳定性,它们能够在溶液中保持膜蛋白的活性,且膜蛋白在纳米盘中的环境与天然膜环境极为相似。
开放数据库与优化提取条件:为了提高提取效率,研究团队开发了一个开放访问的数据库,包含了2,065种膜蛋白的提取条件和效率数据。研究人员可以根据该数据库选择最适合的提取条件,从而快速、高效地提取膜蛋白。
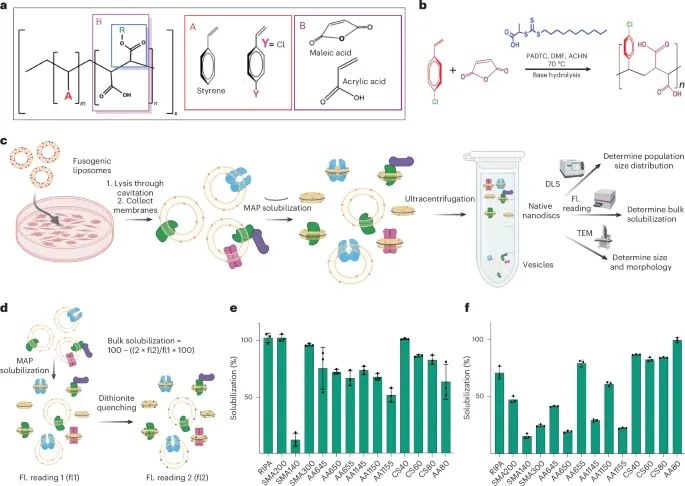
膜活性聚合物(MAPs)库的生成及其用于高通量溶解实验(bulk solubilization assay)的开发过程(Credit: Nature Methods)
图a展示了商业化和自制合成的膜活性聚合物(MAPs)的代表性化学结构。这些MAP的结构通过改变疏水和亲水基团的比例、功能化R基团以及聚合物的分散性来操控,从而形成不同类型的MAP。这种多样性为研究人员提供了多种可能的MAP变体,用以优化膜蛋白提取的效率和特异性。
图b展示了基于RAFT(可控自由基聚合)聚合反应的MAP合成方案。该合成方法使用了PADTC(聚氨基二硫代氨基甲酸酯)、DMF(N,N-二甲基甲酰胺)和ACHN(1,1'-偶氮(氰基环己烷))等试剂,通过聚合反应合成MAP,进一步调整其结构和功能以优化其膜蛋白提取能力。
图c展示了荧光溶解实验的原理图。实验使用了融合脂质体(fusogenic liposomes)来将荧光标记的脂质引入活细胞,标记细胞膜。然后,使用MAPs溶解细胞膜,将溶解后的膜与荧光信号一起收集。通过荧光测量、动态光散射(DLS)和负染色电子显微镜(negative-stain EM)等技术,对溶解效果和膜的均一性进行质量控制。这些实验确保了MAPs能够有效溶解细胞膜,并且纳米盘的形成稳定。
图d展示了溶解定量分析的示意图。在实验中,膜被荧光标记的脂质标记,然后用MAPs溶解。荧光测量的第一个读数(fl1)在膜溶解前读取,接着通过二硫亚磺酸(dithionite)进行猝灭,之后再进行第二次荧光读取(fl2)。通过比较溶解前后的荧光强度,利用公式(1)计算纳米盘的提取效率,从而精确量化膜的溶解情况。
图e和f分别展示了针对HEK293细胞和HeLa细胞的MAP库的高通量溶解筛选实验。在实验中,首先通过融合脂质体将荧光标记的脂质送入细胞标记膜,接着使用不同的MAPs溶解细胞膜,并计算溶解百分比(solubilization efficiency)。如果膜的所有成分都被溶解,那么溶解效率将为100%,即与膜的起始荧光强度相等。实验结果表明,MAPs的溶解效率随着不同聚合物的使用而变化,且通过这些实验,研究人员可以筛选出最有效的MAPs用于膜蛋白的提取。
膜蛋白的提取效率与纯度
在研究中,团队首先验证了该平台的有效性和可重复性。实验表明,这种基于纳米盘的提取方法可以从不同的细胞器膜中高效提取膜蛋白,且提取的膜蛋白具有较高的纯度。研究人员进一步证明了,该平台能够高效地提取并纯化多种膜蛋白,包括来自突触小泡的膜蛋白。实验数据显示,通过这种方法提取的膜蛋白,能够在其天然环境中保持功能,具有很高的生物学活性。
此外,该平台还能够用于多蛋白复合物的提取。例如,研究人员成功地提取了由两种突触小泡膜蛋白(Synaptic vesicle membrane proteins)组成的多蛋白复合物。通过这一方法,研究人员能够更好地理解膜蛋白之间的相互作用及其在细胞中的功能。
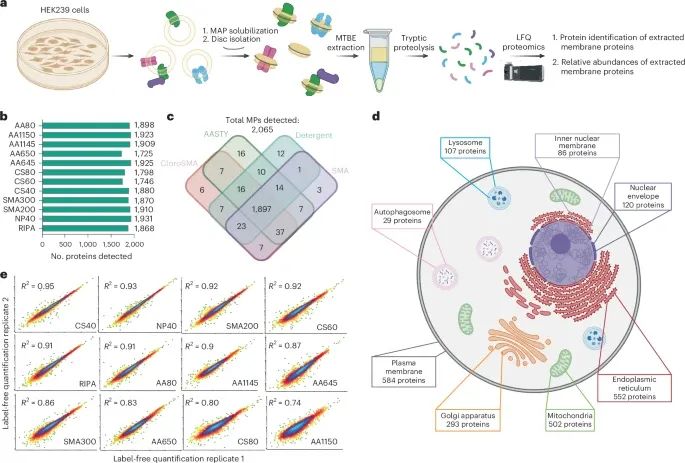
MAPs提取工作流的整合与膜蛋白质组学评估(Credit: Nature Methods)
图a展示了MAP提取工作流的整体流程。在该流程中,首先使用MAP库溶解细胞膜。通过超离心分离获得的MAP纳米盘(MAPdiscs)中,膜蛋白通过MTBE提取沉淀。提取的蛋白质经过还原、烷基化处理,并使用胰蛋白酶进行过夜消化。然后,消化后的肽段进行无标签定量蛋白质组学分析,通过液相色谱-串联质谱(LC-MS/MS)方法进行定量分析。
图b展示了在不同提取条件下,检测到的膜蛋白(MPs)数量。这些数据为评估MAPs在提取膜蛋白中的有效性提供了概述。图中显示,随着不同MAP的使用,提取的膜蛋白数量有所不同,从而反映出不同MAP提取效果的差异。
图c展示了不同提取条件下,膜蛋白覆盖的重叠情况。实验中使用了三类不同的聚合物(SMA系列:SMA200和SMA300;AASTY系列:AASTY645、AASTY650、AASTY1145和AASTY1150;ChloroSMA系列:ChloroSMA40、ChloroSMA60和ChloroSMA80)。尽管存在一定的重叠,结果显示有83个膜蛋白仅在特定MAP条件下被检测到,这表明不同的MAP提取条件能够捕获不同的膜蛋白类型,进一步强调了不同聚合物在提取膜蛋白时的特异性。
图d展示了通过蛋白质组学筛选,在所有细胞膜系统中检测到的膜蛋白。通过将筛选出的膜蛋白与Uniprot数据库中的细胞器信息对比,标注了每个蛋白质的细胞器定位。结果表明,MAP溶解不仅限于细胞膜的表面蛋白质,还包括来自所有膜包被细胞器的蛋白质。这表明,MAPs的溶解效果不仅限于细胞膜,而是能够有效溶解所有细胞器的膜蛋白,从而获得全面的膜蛋白数据。
图e展示了在不同生物学重复实验中,各种蛋白质的定量变异性。实验通过将不同生物学重复之间的数据进行比较,评估了MAP提取的重现性。结果显示,大多数MAPs表现出极高的重复性(R²接近1),即提取过程高度可重复。然而,AASTY1150在溶解实验中表现较差,并且在重复实验中的表现也较差,说明其溶解效果不稳定,重复性较差。
开放数据库
为进一步推广该技术,研究团队开发了一个开放访问的数据库( https://polymerscreen.yale.edu 或 https://polymerscreen.streamlit.app; RRID: SCR_025656),包含了2,065种膜蛋白的提取数据。这个数据库详细记录了每种膜蛋白在不同聚合物下的提取效率,并提供了最适合的提取条件。研究人员可以通过这个数据库快速查找适合的膜蛋白提取方案,从而提高实验效率,避免重复实验。
突破传统方法的局限性
相比传统的去膜剂方法,这种纳米盘提取技术具有多项优势:
保留膜蛋白的天然环境:传统方法使用去膜剂破坏细胞膜,导致膜蛋白功能的丧失,而纳米盘能够在膜蛋白的天然膜环境中稳定其结构和功能。这使得纳米盘方法能够更准确地反映膜蛋白在生理状态下的行为。
高效提取与纯化:通过纳米盘技术,膜蛋白的提取效率大大提高,且提取出的膜蛋白纯度较高。实验结果显示,纳米盘平台能够从多种不同的细胞器膜中提取膜蛋白,并保持其生物活性。这一优势为膜蛋白的研究提供了更为可靠的实验材料。
高通量应用:纳米盘技术不仅能在单个膜蛋白的提取中取得成功,还能够进行高通量膜蛋白提取。结合开放数据库中的优化提取条件,研究人员可以在短时间内处理大量膜蛋白样本,快速获取膜蛋白的结构、功能及相互作用数据。
扩展到多蛋白复合物:除了单一的膜蛋白,纳米盘平台还能够提取由多个膜蛋白组成的复合物。这一特性使得研究人员能够研究膜蛋白复合物的形成和相互作用,对于理解细胞内膜蛋白的功能和调控机制具有重要意义。
药物开发与应用前景
膜蛋白是许多药物的靶点,因此,能够在其天然膜环境中准确提取膜蛋白,对于药物研发具有重要意义。随着该平台的进一步推广,研究人员能够更加精确地模拟膜蛋白的天然环境,从而为药物设计提供更为准确的靶点信息。
例如,许多离子通道、G蛋白偶联受体(GPCRs)等膜蛋白都是目前药物研发中的重要靶点。通过这种新平台,药物研发者可以更加直观地了解这些靶点的结构和功能,从而设计出更具特异性和效果的药物。
尽管该平台在膜蛋白提取和分析方面展示了巨大的潜力,但仍然面临一些挑战。首先,尽管该平台能够保留膜蛋白的天然环境,但膜蛋白的复杂性和多样性仍然给研究带来了困难。不同类型的膜蛋白对提取条件的要求不同,因此需要进一步优化聚合物库,以适应更多种类膜蛋白的提取。
其次,该平台虽然能够高效地提取膜蛋白,但在蛋白质结构解析方面,仍需要进一步结合其他技术,如电子显微镜(Electron Microscopy,EM)、质谱(Mass Spectrometry)等,以获得更为详细的结构信息。通过与其他结构生物学技术的结合,可以更全面地理解膜蛋白的功能和机制。
总体而言,这项基于纳米盘的膜蛋白提取平台,不仅在技术上实现了突破,也为膜蛋白研究开辟了新的方向。通过这种方法,研究人员可以更加接近膜蛋白的天然状态,从而揭示膜蛋白在细胞中的复杂功能和相互作用。随着这一平台的推广和完善,膜蛋白研究将进入一个全新的时代,为生物学、医学和药物研发带来更多可能。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


