Nature Methods:蛋白质复合物研究的新利器——Foldseek-Multimer
来源:生物探索 2025-02-08 09:58
Foldseek-Multimer这一突破性技术的核心优势在于,它能够在极短的时间内对数百万个蛋白质复合物进行全方位比对。
蛋白质复合物是执行细胞内复杂功能的关键分子,了解这些复合物的结构,不仅有助于揭示其功能机制,还能够为药物研发和疾病治疗提供新的思路。然而,随着研究的深入,蛋白质复合物的数量与复杂性急剧增加,如何快速、准确地比对和分析这些结构,成为了一个亟待解决的难题。
传统的蛋白质复合物比对方法面临着计算量大、时间长等挑战,尤其是在处理庞大的数据库时,计算速度和准确性之间的平衡一直是研究的难点。为了解决这一问题,2月5日Nature Methods的研究报道“Rapid and sensitive protein complex alignment with Foldseek-Multimer”,研究人员开发了Foldseek-Multimer,一个全新的蛋白质复合物比对工具。Foldseek-Multimer通过结合高效的链对链比对和超位聚类技术,在比对蛋白质复合物时,比现有的传统工具快了3到4个数量级,同时能够保持较高的比对准确性。
这一突破性技术的核心优势在于,它能够在极短的时间内对数百万个蛋白质复合物进行全方位比对。在处理如PDB数据库这样的庞大数据集时,Foldseek-Multimer的高效算法不仅加速了比对过程,还保证了在低序列相似度的情况下,仍能发现具有结构相似性的复合物。这样,Foldseek-Multimer为研究人员提供了一种新的工具,能够在短短几小时内完成数十亿对复合物的比对,为蛋白质复合物的研究和药物靶点的发现开辟了新的前景。
随着AlphaFold等预测工具的不断进步,预测蛋白质复合物的三维结构变得越来越精确,而Foldseek-Multimer的出现,更加加速了对这些预测结果的验证和应用。它的快速、高效使得我们能够更加深入地探索蛋白质复合物的多样性与复杂性,为解锁生命的奥秘提供了重要的技术支持。

蛋白质复合物:生命的“工厂”
在细胞中,蛋白质复合物是执行各项生物功能的核心“工厂”。这些复合物通常由多个蛋白质亚单位组成,它们通过相互作用协调工作,完成包括基因表达、细胞信号传导、免疫反应等关键生物过程。每个蛋白质复合物的结构和功能高度依赖其亚单位的精准配对与空间排列。比如,DNA复制过程中的聚合酶复合物,由多个蛋白质子单元组成,确保DNA能够高效、准确地复制。再比如,细胞的免疫反应常依赖于复杂的抗体-抗原结合机制,其中的蛋白质复合物发挥着决定性的作用。
随着技术的发展,研究人员已能够通过高分辨率的技术手段,例如X射线晶体学、核磁共振(NMR)和冷冻电镜(cryo-EM)等,解析出越来越多的蛋白质复合物的结构。然而,尽管这些技术提供了重要的结构信息,随着蛋白质复合物数量的急剧增加,如何系统地比对和理解这些结构,成为了新的挑战。
蛋白质复合物的复杂性不仅体现在它们由多个子单位组成,还表现在它们可以在不同的生理条件下改变结构和功能。例如,某些复合物在细胞内信号传递过程中可能发生动态的构象变化,这一变化直接影响其生物学功能。比如,受体与配体的结合会引发受体的构象改变,从而激活下游信号通路。因此,理解这些复杂的结构和功能,不仅要求我们掌握单个蛋白质的结构,还需要揭示它们在复合物中的相互作用和协同效应。
蛋白质结构比对的挑战
蛋白质复合物的结构比对是生物学研究中至关重要的任务,尤其是在探索不同蛋白质复合物之间的相似性和差异时。然而,传统的比对方法面临着显著的挑战。最主要的问题之一就是计算量庞大,尤其是在比对复杂的多链蛋白质复合物时,传统方法往往需要大量的时间和计算资源。例如,使用US-align工具对931对蛋白质复合物进行比对时,使用一个单核服务器进行计算,US-align的比对时间就长达13天。显然,随着数据库中蛋白质复合物数量的增加,传统方法在速度上的局限性逐渐显现。
此外,蛋白质复合物比对不仅仅依赖于结构的精准对齐,还需要解决如何正确配对每一个蛋白质链的问题。由于蛋白质复合物通常由多个子单元组成,正确的链配对是确保比对准确性的关键。但由于蛋白质结构的复杂性和多样性,尤其是在低序列相似度的情况下,准确的链配对变得尤为困难。比如,US-align方法采用了一种贪婪搜索策略来提出候选链配对,并通过动态编程进行优化,这使得其能在一定程度上提高比对速度,但依然难以突破大规模数据库比对中的瓶颈。
这种速度和准确性之间的矛盾使得传统比对方法在面对庞大的蛋白质复合物数据集时显得力不从心。为了提高比对效率,许多研究尝试通过预筛选步骤来减少需要比对的复合物对数。例如,QSalign方法通过基于序列相似度的预筛选,减少了比对的复合物数量,从而加快了比对过程。然而,这种预筛选方式虽然能节省计算时间,却可能牺牲了灵敏度,特别是在低序列相似度区间时,可能错过一些潜在的结构相似性。
在蛋白质复合物比对的挑战中,速度和准确性的平衡成为了核心问题。如何提高比对速度的同时,保证比对结果的准确性,始终是研究人员关注的焦点。随着Foldseek-Multimer的出现,这一问题得到了突破。Foldseek-Multimer利用高效的链对链比对和超位聚类算法,使得比对速度大幅提升。
Foldseek-Multimer:蛋白质比对的新革命
首先,Foldseek-Multimer的核心技术在于高效的链对链比对和超位聚类算法的结合。传统的蛋白质结构比对方法需要逐一处理每一对蛋白质链的对齐,而Foldseek-Multimer则通过Foldseek的快速链对链比对算法,极大提高了计算效率。其独特之处在于,Foldseek-Multimer将每一个链对链的比对表示为超位向量(superposition vectors),这些向量记录了链对链对齐的旋转和翻译信息。这使得比对过程不再局限于简单的逐对比对,而是通过超位聚类算法来高效地处理大规模的复合物比对。
通过DBSCAN(Density-Based Spatial Clustering of Applications with Noise)算法,Foldseek-Multimer能够对这些超位向量进行迭代聚类,识别出结构相似的复合物,并快速计算出最优的比对结果。值得注意的是,DBSCAN算法无需预先设定聚类数量,能够根据数据的分布自动调整聚类参数,这大大提高了比对的灵活性和准确性。通过这种方式,Foldseek-Multimer在短时间内可以完成数百万个蛋白质复合物对的比对,且比对质量与传统方法相媲美。
Foldseek-Multimer的速度提升尤为显著。研究人员将Foldseek-Multimer与传统工具US-align进行对比,结果显示,Foldseek-Multimer在执行相同的931对蛋白质复合物比对时,比US-align快了超过100倍。在面对庞大的数据库时,Foldseek-Multimer的优势更加明显。例如,它能够在11小时内完成对57亿对复合物的比对,而传统方法可能需要数月才能完成。这一突破使得蛋白质复合物比对的工作变得更加高效,极大地推动了结构生物学的研究进程。
此外,Foldseek-Multimer在处理低序列相似度的复合物比对时,表现出极高的灵敏度。在比对过程中,Foldseek-Multimer不仅依赖序列相似度,还通过结构信息的匹配识别出潜在的结构相似性。例如,在使用Foldseek-Multimer比对PDB数据库中的一个CRISPR-Cas系统时,尽管查询复合物与数据库中的相似复合物序列相似度仅为11.1%到19.8%,Foldseek-Multimer依然能够识别出这些结构之间的相似性,并提供有效的比对结果。这一点尤其重要,因为许多重要的生物学发现往往存在于低序列相似度的复合物之间,Foldseek-Multimer的高灵敏度能够确保这些潜在的结构相似性不会被忽视。
通过快速且准确的大规模比对,Foldseek-Multimer不仅加速了蛋白质复合物的比对过程,也为研究人员提供了更多的结构相似性线索,推动了复杂生物学问题的解决。
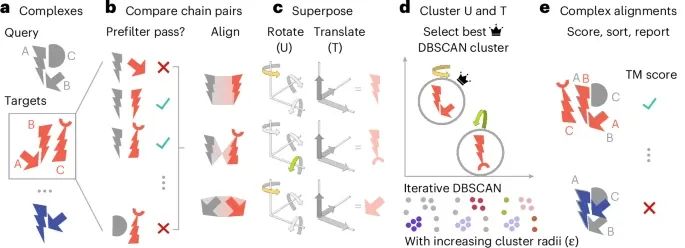
Foldseek-Multimer在蛋白质复合物结构比对中的工作原理和流程(Credit: Nature Methods)
快速查询功能:Foldseek-Multimer能够将输入的蛋白质复合物(或多个复合物)快速查询到一个大型数据库中,这个数据库可能包含数百万个目标复合物。通过这种方式,Foldseek-Multimer能够有效地缩小比对范围,提升比对效率。
链对链比对:图中的每一个链(灰色)会与目标复合物中的每一个链(红色)进行比对。为了提高计算效率,Foldseek-Multimer使用了预筛选功能,能够快速排除那些不匹配的链对,确保仅对潜在的结构相似复合物对进行全面的比对。
超位对齐表示:Foldseek-Multimer将每一对链对链的比对表示为超位(superposition),通过旋转和平移来实现目标链与查询链的对接。在简化的示例中,两个链对链比对(上方和下方)是沿着同一轴旋转(用黄色和绿色高亮显示),而中间的比对则是沿着不同的轴旋转。这一过程体现了如何通过几何变换对链进行精确对齐。
复合物对复合物的比对:通过对多个链对链的比对进行整合,Foldseek-Multimer推导出复合物对复合物的最终比对结果。在此过程中,链对链的超位表示相似性被用来确定复合物的比对质量。Foldseek-Multimer使用DBSCAN算法进行迭代聚类,通过逐步增大聚类半径来识别最佳的超位聚类,从而计算出复合物对复合物的最优比对。
TM评分计算:在选择了得分最优的聚类后,Foldseek-Multimer会基于该聚类计算复合物之间的TM评分。TM评分是通过计算查询复合物与目标复合物之间的所有链对链的比对结果来评估复合物间的结构相似性。
与AlphaFold的结合:蛋白质结构预测新时代
随着AlphaFold等蛋白质结构预测工具的问世,蛋白质三维结构的预测进入了一个崭新的时代。AlphaFold通过深度学习技术,能够以惊人的精度预测单链蛋白质的三维结构,而Foldseek-Multimer则在此基础上提供了强有力的支持,特别是在蛋白质复合物的结构比对与验证方面。二者的结合,不仅加速了蛋白质结构研究的进程,也为探索蛋白质功能和相互作用提供了全新的视角。
AlphaFold的出现为蛋白质结构预测提供了一个强大的工具,它在单链蛋白质的结构预测中表现出了前所未有的准确性。然而,面对复杂的蛋白质复合物时,虽然能够进行一些预测,但这些复合物的准确预测仍然面临挑战。复合物通常涉及多个亚单位,它们之间的相互作用以及在不同环境下的构象变化使得预测的复杂性成倍增加。因此,尽管AlphaFold能够预测单一蛋白质的结构,但要对多个蛋白质亚单位进行精确的结构预测,还需要进一步的验证和比对工具来确认这些结构的合理性。
这时,Foldseek-Multimer的作用便尤为突出。通过高效的蛋白质复合物比对功能,Foldseek-Multimer能够对AlphaFold预测的蛋白质复合物结构进行快速验证。以AlphaFold预测的CRISPR-Cas复合物为例,研究人员将这些预测结果作为查询,使用Foldseek-Multimer与数据库中的已知结构进行比对。在这项实验中,Foldseek-Multimer不仅能够快速找出结构相似的复合物,还能确认预测结构的正确性。这种结合使得蛋白质复合物的结构预测不再仅仅依赖于计算预测,而是通过真实的结构数据进行验证,从而提高了预测的准确性和可靠性。
更进一步,Foldseek-Multimer与AlphaFold的结合,将推动蛋白质复合物研究的前沿发展。借助Foldseek-Multimer的高效比对能力,研究人员可以快速地对数百万个蛋白质复合物的预测结构进行比对和验证。例如,在对PDB数据库的比对中,Foldseek-Multimer能够在短短几小时内完成57亿对复合物的比对,进而帮助研究人员从中筛选出最相关的复合物结构。这种高效、准确的比对不仅节省了大量的计算时间,也使得大规模的蛋白质复合物研究成为可能。
结合AlphaFold的结构预测能力和Foldseek-Multimer的高效比对算法,研究人员能够更快、更准地探索蛋白质复合物的结构与功能。这种协同效应不仅加速了新型蛋白质功能的发现,也为药物靶点的筛选提供了全新的方法。
Foldseek-Multimer:加速药物研发与疾病治疗
随着生物医药领域的不断发展,药物研发正面临着越来越多的挑战,尤其是在新药靶点的发现和疾病相关蛋白质的研究方面。传统的药物发现方法通常依赖于靶点的实验验证,这一过程既耗时又成本高昂。Foldseek-Multimer的出现,为药物研发带来了前所未有的高效性,它通过结构比对技术,能够迅速识别蛋白质复合物的结构相似性,为药物靶点的发现提供了新的方向。
在药物研发过程中,靶点的选择是成功的关键。有效的靶点通常是与特定疾病相关的蛋白质或蛋白质复合物。Foldseek-Multimer通过其高效的比对算法,可以帮助研究人员在海量的蛋白质数据库中找到与目标复合物相似的其他复合物。例如,在对PDB数据库中已有的蛋白质复合物进行比对时,Foldseek-Multimer能够快速识别出功能相似的蛋白质复合物,这为潜在的药物靶点筛选提供了有力支持。
更为关键的是,Foldseek-Multimer不仅可以找到结构上相似的蛋白质,还能够在低序列相似度的情况下揭示它们之间的结构相似性。这一点对于研究那些具有较低序列相似度但功能相似的蛋白质复合物尤为重要。许多疾病相关蛋白质,如癌症和神经退行性疾病中的蛋白质复合物,往往具有较低的序列相似性,传统方法很难发现这些潜在的靶点。而Foldseek-Multimer凭借其超位聚类算法,能够突破这一限制,帮助研究者在不同物种和疾病状态下找到潜在的药物靶点。
此外,Foldseek-Multimer在加速疾病相关蛋白质复合物研究方面的潜力也非常巨大。在研究一些复杂疾病时,研究人员通常需要分析大量的蛋白质复合物及其相互作用,才能找到疾病的潜在机制。然而,传统的比对方法往往由于计算量过大、比对速度慢而限制了这一过程的深入。Foldseek-Multimer的出现,极大地加速了这一过程。通过它的高效比对功能,研究人员能够在短时间内对成千上万的蛋白质复合物进行结构比对,从而更快速地识别出可能与疾病相关的蛋白质复合物。
例如,针对一些病毒感染或癌症相关的蛋白质复合物,Foldseek-Multimer可以快速比对不同患者样本中的蛋白质复合物,找出其中的共同特征。这不仅能够加速疾病研究,也能帮助科研人员更精确地找到可能的治疗靶点,为开发新药提供坚实的基础。
通过将Foldseek-Multimer应用于药物研发和疾病研究,研究人员能够更加高效地筛选出潜在靶点,缩短药物开发周期,并提高药物研发的成功率。这一技术的出现,无疑为生物医药领域带来了革命性的变化,为我们攻克多种疾病、特别是复杂疾病,提供了前所未有的机遇。随着Foldseek-Multimer不断优化,其在药物发现和疾病治疗中的应用潜力将会进一步释放,成为生物医药领域的重要工具。
Foldseek-Multimer未来的潜力不仅限于现有的蛋白质复合物研究。随着RNA和DNA复合物结构研究的推进,Foldseek-Multimer的技术框架可以扩展到这些新的研究领域。例如,RNA和DNA也存在着多种复合物形式,它们的结构与功能同样复杂且关键。Foldseek-Multimer可以通过借鉴其在蛋白质复合物中的成功经验,为RNA和DNA复合物的比对与结构分析提供新的解决方案。这一扩展将进一步推动分子生物学、基因组学和细胞生物学的研究进程。Foldseek-Multimer不仅改变了蛋白质复合物的比对方式,还为未来的生物学研究提供了全新的视角和技术手段。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


